1 . 钒基笼目金属在超导电性方面有广阔的应用前最。某钒基笼目金属(M)的晶体结构如图所示。
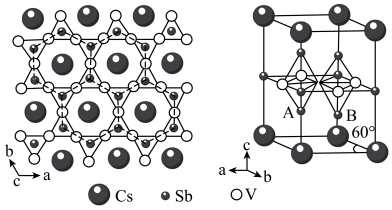
(1)Sb在元素周期表中的位置是___________ 。
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为___________ 。
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_________ ,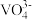 的空间结构为
的空间结构为________ 。
(4)SbH3的键角比NH3的键角小,原因是___________ 。
(5)该钒基笼目金属(M)的化学式为___________ ,与V原子距离最近且等距的V原子________ 个。
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为___________ Å ( ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。

(1)Sb在元素周期表中的位置是
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为
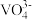 的空间结构为
的空间结构为(4)SbH3的键角比NH3的键角小,原因是
(5)该钒基笼目金属(M)的化学式为
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为
 ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。
您最近一年使用:0次
名校
解题方法
2 . 残渣油中含有大量的有机物,还含有少量金属元素Mo、V、Ni、Fe的硫化物,其中Mo、V的含量最高,回收价值最大。但因油的粘度较大,增大了回收的难度,工业生产中从残渣油里回收V、Mo的工艺流程如图所示。
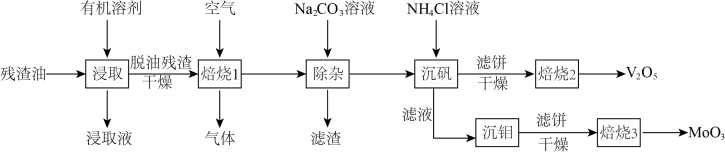
已知:① 微溶于冷水、乙醉、乙醚,能溶于热水:
微溶于冷水、乙醉、乙醚,能溶于热水:
②“除杂”步骤后的 、
、 以
以 利
利 离子的形式存在;
离子的形式存在;
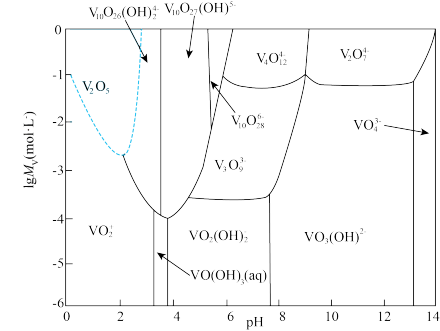
③钒在不同 、不同浓度下的存在形态如图,其中
、不同浓度下的存在形态如图,其中 可简写成
可简写成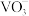 。
。
回答下列问题:
(1)已知 和
和 是同族相邻元素,写出Mo的外围电子轨道表示式
是同族相邻元素,写出Mo的外围电子轨道表示式___________ 。
(2)脱油残渣空气焙烧的目的是___________ 。
(3)“焙烧1”时生成的气体成分是___________ 。
(4)用碳酸钠溶液除杂,调节 值范围为
值范围为___________ 。
(5)“沉钒”时,发现随着温度升高,沉钒率反而下降,推测可能的原因是___________ 。
(6)在“焙烧2”制备 的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是___________ ;若在空气中焙烧,可生成一种无毒气体,该反应的化学方程式为___________ 。

已知:①
 微溶于冷水、乙醉、乙醚,能溶于热水:
微溶于冷水、乙醉、乙醚,能溶于热水:②“除杂”步骤后的
 、
、 以
以 利
利 离子的形式存在;
离子的形式存在;③钒在不同
 、不同浓度下的存在形态如图,其中
、不同浓度下的存在形态如图,其中 可简写成
可简写成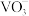 。
。
回答下列问题:
(1)已知
 和
和 是同族相邻元素,写出Mo的外围电子轨道表示式
是同族相邻元素,写出Mo的外围电子轨道表示式(2)脱油残渣空气焙烧的目的是
(3)“焙烧1”时生成的气体成分是
(4)用碳酸钠溶液除杂,调节
 值范围为
值范围为(5)“沉钒”时,发现随着温度升高,沉钒率反而下降,推测可能的原因是
(6)在“焙烧2”制备
 的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
您最近一年使用:0次
名校
解题方法
3 . 过渡金属元素在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)原子序数为21~30的元素基态原子中,未成对电子数最多的元素在周期表中的位置是___________ ,其价层电子排布图(轨道表示式)为___________ 。
(2)基态钒原子核外电子的运动状态有___________ 种。
(3)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中配体Htrz 为1,2,4- 三氮唑( )分子。
)分子。
①该配合物中,阴离子的空间结构为___________ ,其中心原子的杂化轨道类型是___________ 。
②1个 分子中,σ键的个数为
分子中,σ键的个数为___________ 。
(4)二茂铁[Fe(C5H5)2] 不溶于水,易溶于乙醇等有机溶剂。乙醇的沸点(78.5 ℃)介于水的沸点(100 ℃)和乙硫醇(CH3CH2SH)的沸点(36.2 ℃)之间,其原因是___________ 。
(5)铁单质和氨气在640 ℃ 可发生置换反应,产物之一的晶胞结构如图所示(黑球代表Fe,白球代表N),该反应的化学方程式为___________ 。若该晶体的密度是ρ g·cm-3,则两个距离最近的Fe原子间的距离为___________ nm (列出计算式,设NA为阿伏加德罗常数的值)。

(1)原子序数为21~30的元素基态原子中,未成对电子数最多的元素在周期表中的位置是
(2)基态钒原子核外电子的运动状态有
(3)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中配体Htrz 为1,2,4- 三氮唑(
 )分子。
)分子。①该配合物中,阴离子的空间结构为
②1个
 分子中,σ键的个数为
分子中,σ键的个数为(4)二茂铁[Fe(C5H5)2] 不溶于水,易溶于乙醇等有机溶剂。乙醇的沸点(78.5 ℃)介于水的沸点(100 ℃)和乙硫醇(CH3CH2SH)的沸点(36.2 ℃)之间,其原因是
(5)铁单质和氨气在640 ℃ 可发生置换反应,产物之一的晶胞结构如图所示(黑球代表Fe,白球代表N),该反应的化学方程式为

您最近一年使用:0次
4 . 铁(Fe)、钴(Co)、镍(Ni)在化学上称为铁系元素,其化合物在生产生活中应用广泛。
(1)Fe、Co、Ni位于周期表的___________ 区,基态Ni转化为下列激发态时所需能量最少的是___________ (填字母)。
A. B.
B.
C. D.
D.
(2)铁系元素能与CO形成 、
、 等金属羰基化合物。
等金属羰基化合物。 中Fe的杂化轨道类型为___________(填字母)。
中Fe的杂化轨道类型为___________(填字母)。
(3)以甲醇为溶剂, 可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。

色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为___________ ,X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个 分子,
分子, 是通过
是通过___________ 作用与色胺酮钴配合物相结合。
(4)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是___________ 。
(5)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图甲所示:

距离Mg原子最近的Ni原子有___________ 个,该晶胞沿面对角线投影如图乙所示,则Ni的位置为___________ (填序号)。

(1)Fe、Co、Ni位于周期表的
A.
 B.
B.
C.
 D.
D.
(2)铁系元素能与CO形成
 、
、 等金属羰基化合物。
等金属羰基化合物。 中Fe的杂化轨道类型为___________(填字母)。
中Fe的杂化轨道类型为___________(填字母)。A. | B. | C. | D. |
 可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为
 分子,
分子, 是通过
是通过(4)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是
(5)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图甲所示:

距离Mg原子最近的Ni原子有

您最近一年使用:0次
5 . 铁、镍、铜在医药、催化及材料等领域中都有广泛的应用。回答下列问题:
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为___________ (填轨道表示式)。
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为___________ 。
②不存在的化学键有___________ (填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
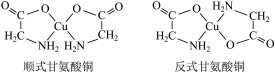
①甘氨酸铜中氮原子的杂化类型为___________ 。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是___________ 。
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1, ),Y的坐标为(
),Y的坐标为( ,
, ,
, ),设NA为阿伏加德罗常数的值。坐标为(
),设NA为阿伏加德罗常数的值。坐标为( ,1,
,1, )的是
)的是___________ 原子,Se原子X与Se原子Y之间的距离为___________ nm,该晶体的密度为___________ g·cm-3。
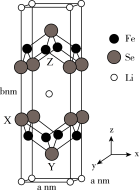
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为
②不存在的化学键有
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中氮原子的杂化类型为
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1,
 ),Y的坐标为(
),Y的坐标为( ,
, ,
, ),设NA为阿伏加德罗常数的值。坐标为(
),设NA为阿伏加德罗常数的值。坐标为( ,1,
,1, )的是
)的是
您最近一年使用:0次
名校
解题方法
6 . 氟化镁钾(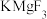 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。

(1)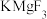 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的 。
。
(2)进行离子取代的重要参数为离子半径。下表是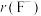 、
、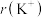 、
、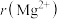 的数据,请从原子结构角度解释
的数据,请从原子结构角度解释 的原因:
的原因:___________ 。
(3) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料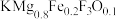 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为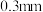 。面积为
。面积为 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
( ,
, ,阿伏加德罗常数约为
,阿伏加德罗常数约为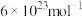 )。
)。
(4)我国科研工作者以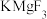 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子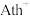 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型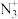 。已知
。已知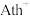 与
与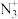 的结构简式如下:
的结构简式如下:
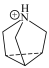
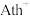 :
:
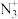 :
:
①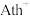 中N原子的杂化方式为
中N原子的杂化方式为___________ ,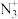 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
②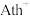 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与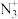 还存在着
还存在着___________ ,上述相互作用不会随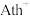 的转动改变。
的转动改变。
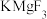 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
(1)
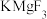 晶体中,每个
晶体中,每个 周围有
周围有 。
。(2)进行离子取代的重要参数为离子半径。下表是
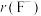 、
、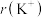 、
、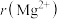 的数据,请从原子结构角度解释
的数据,请从原子结构角度解释 的原因:
的原因:| 离子 |  |  |  |
离子半径 | 136 | 65 | 133 |
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
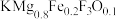 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为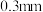 。面积为
。面积为 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
( ,
, ,阿伏加德罗常数约为
,阿伏加德罗常数约为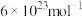 )。
)。(4)我国科研工作者以
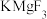 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子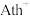 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型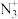 。已知
。已知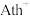 与
与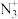 的结构简式如下:
的结构简式如下: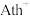 :
:
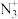 :
:
①
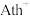 中N原子的杂化方式为
中N原子的杂化方式为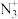 中心N原子的杂化方式为
中心N原子的杂化方式为②
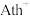 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与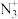 还存在着
还存在着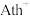 的转动改变。
的转动改变。
您最近一年使用:0次
2023-05-28更新
|
247次组卷
|
2卷引用:北京市清华大学附属中学2023届高三三模化学试题
7 .  失水后可转为
失水后可转为 ,与
,与 可联合制备铁粉精(
可联合制备铁粉精( )和
)和 。按要求回答下列问题。
。按要求回答下列问题。
I. 的结构如图所示。
的结构如图所示。

(1) 价层电子的轨道表示式为
价层电子的轨道表示式为___________ 。
(2) 中的键角比
中的键角比 分子中的
分子中的___________ 。(填“大”、“小”或“一样大”)
(3)图中 分别与
分别与 、
、 的作用力为
的作用力为___________ 、___________ 。
Ⅱ.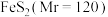 晶胞为立方体,棱长为apm,如图所示:
晶胞为立方体,棱长为apm,如图所示:
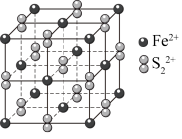
(4)与 等距且紧邻的
等距且紧邻的 离子个数为
离子个数为___________ 。晶胞的密度为___________ g⋅cm (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列算式)。
,列算式)。
(5)以 为燃料,联合
为燃料,联合 的分解,制备铁粉精(
的分解,制备铁粉精( )和
)和 。
。
①结合下列“ 分解”、“
分解”、“ 与
与 反应”分别生成
反应”分别生成 的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:
的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:___________ 。
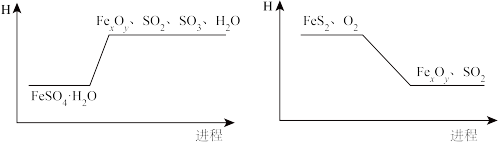
②此过程中,发生氧化反应的物质为___________ 。
 失水后可转为
失水后可转为 ,与
,与 可联合制备铁粉精(
可联合制备铁粉精( )和
)和 。按要求回答下列问题。
。按要求回答下列问题。I.
 的结构如图所示。
的结构如图所示。
(1)
 价层电子的轨道表示式为
价层电子的轨道表示式为(2)
 中的键角比
中的键角比 分子中的
分子中的(3)图中
 分别与
分别与 、
、 的作用力为
的作用力为Ⅱ.
 晶胞为立方体,棱长为apm,如图所示:
晶胞为立方体,棱长为apm,如图所示:
(4)与
 等距且紧邻的
等距且紧邻的 离子个数为
离子个数为 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列算式)。
,列算式)。(5)以
 为燃料,联合
为燃料,联合 的分解,制备铁粉精(
的分解,制备铁粉精( )和
)和 。
。①结合下列“
 分解”、“
分解”、“ 与
与 反应”分别生成
反应”分别生成 的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:
的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:
②此过程中,发生氧化反应的物质为
您最近一年使用:0次
8 . 铜及其化合物在生产生活中有着广泛的应用。请回答:
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)___________ I2(Zn)(填“>”、“=”或“<”)。。
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:
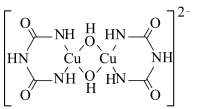
①该阴离子中所有元素的电负性从大到小的顺序为___________ 。
②该阴离子中氧原子的杂化方式为___________ ;
③lmol该阴离子含有σ键的数目为___________ ;
④该配合物中心铜离子的外围电子排布图为___________ ;
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。

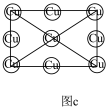
①该合金随温度升高,电导率_______ (填“升高”或“降低”或“不变”) ,原因为________ ;
②在图c中画出上图b切面上的Al和Mn的相对位置___________ (不考虑各原子的大小)。
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:

①该阴离子中所有元素的电负性从大到小的顺序为
②该阴离子中氧原子的杂化方式为
③lmol该阴离子含有σ键的数目为
④该配合物中心铜离子的外围电子排布图为
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。


①该合金随温度升高,电导率
②在图c中画出上图b切面上的Al和Mn的相对位置
您最近一年使用:0次
9 . Fe3+可以与SCN-、CN-、有机分子等形成配合物,中国研究团队研发的一种智能比色微针贴片,用于按需治疗和实时报告伤口感染,可由聚乙烯吡咯烷酮(PVP) 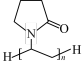 、没食子酸
、没食子酸 和铁离子之间的配位反应制备。回答下列问题:
和铁离子之间的配位反应制备。回答下列问题:
(1)基态Fe3+的价电子排布图(轨道表示式)为___________ 。
(2)写出一种与SCN-互为等电子体的分子:___________ (填化学式)。1mol [Fe(CN)6]3-中含有σ键的数目为___________ 。
(3)PVP 中N原子的杂化轨道类型为___________ ; 没食子酸沸点高于2, 3, 4-三羟基苯甲酸(如图所示) 的原因是___________ 。

(4)下表数据是部分氯化物的熔点:
判断FeCl3的晶体类型为___________ ; 400°C时FeCl3蒸气中有以配位键结合的双聚分子,画出该双聚分子结构: ___________ 。
(5)普鲁士蓝晶体属于立方晶系,晶体密度为ρg·cm-3,铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点,CN- 在小立方体的棱上,两端均与Fe粒子相连,小立方体中心空隙可容纳K+,如图所示(CN- 在图中已省略)。

该晶胞棱长为___________ pm(阿伏加德罗常数为NA)。
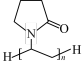 、没食子酸
、没食子酸 和铁离子之间的配位反应制备。回答下列问题:
和铁离子之间的配位反应制备。回答下列问题:(1)基态Fe3+的价电子排布图(轨道表示式)为
(2)写出一种与SCN-互为等电子体的分子:
(3)PVP 中N原子的杂化轨道类型为

(4)下表数据是部分氯化物的熔点:
| 编号 | ① | ② | ③ |
| 物质 | NaCl | AlCl3 | FeCl3 |
| 熔点°C | 801 | 160 | 306 |
(5)普鲁士蓝晶体属于立方晶系,晶体密度为ρg·cm-3,铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点,CN- 在小立方体的棱上,两端均与Fe粒子相连,小立方体中心空隙可容纳K+,如图所示(CN- 在图中已省略)。

该晶胞棱长为
您最近一年使用:0次
解题方法
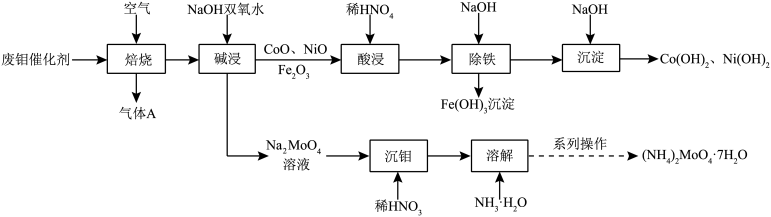
10 . 废钼催化剂中钼、钴、镍等金属作为二次资源可加以回收利用,一种从废钼催化剂(主要成分为MoO3、MoS2,含少量CoO、CoS、NiO、Fe2O3等)中回收金属的一种工艺流程如图:
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)Ni2+价层电子轨道表示式为________ ,“焙烧”时产生的气体A的主要成分为________ 。
(2)“焙烧”时MoS2转化为MoO3,写出“碱浸”时MoO3参与反应的离子方程式_________ 。
(3)“除铁”时应调节溶液pH的范围为___________ ,“沉淀”时调节溶液pH=9.0,则此时溶液中[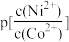 =
=___________ (pX=-lgX)。
(4)“系列操作”为________ 、________ 、过滤、洗涤、干燥得到(NH4)2MoO4·7H2O晶体。
(5)50.00kg该废钼催化剂(含Mo元素质量分数为10.56%)通过该工艺最终得到15.05kg七水钼酸铵(相对分子质量为322)产品,则该工艺中七水钼酸铵的收率为___________ %(保留小数点后一位数字,收率= )。
)。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Co2+ | Ni2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 2.2 3.2 | 6.4 9.0 | 7.2 8.7 |
(1)Ni2+价层电子轨道表示式为
(2)“焙烧”时MoS2转化为MoO3,写出“碱浸”时MoO3参与反应的离子方程式
(3)“除铁”时应调节溶液pH的范围为
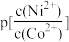 =
=(4)“系列操作”为
(5)50.00kg该废钼催化剂(含Mo元素质量分数为10.56%)通过该工艺最终得到15.05kg七水钼酸铵(相对分子质量为322)产品,则该工艺中七水钼酸铵的收率为
 )。
)。
您最近一年使用:0次



