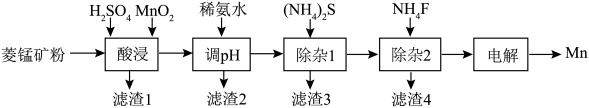
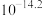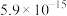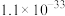1 . 工业上以菱锰矿(主要成分为MnCO3,含杂质CaCO3、FeCO3、NiCO3)为原料制取金属锰的工艺流程如下:
已知常温下,溶度积常数(Ksp)如下表:
(1)基态Mn2+的价层电子轨道表示式为___________ , 的空间结构为
的空间结构为___________ 。
(2)“酸浸”时,为了加快反应速率,可采取的措施有___________ (答两条),该过程一般选择硫酸而不用盐酸的原因是___________ 。
(3)“酸浸”过程中,MnO2发生的主要反应的离子方程式为___________ 。
(4)常温下,加稀氨水时调pH约为4,则滤渣2的主要成分是___________ 。
(5)“除杂1”时加入适量的(NH4)2S,除去的主要离子为___________ ,过滤后得到的滤液中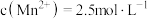 ,则其
,则其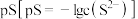 的范围是
的范围是___________ 。

已知常温下,溶度积常数(Ksp)如下表:
 |  |  |  |  |  |
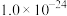 | 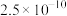 | 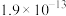 |  | 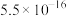 | 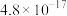 |
(1)基态Mn2+的价层电子轨道表示式为
 的空间结构为
的空间结构为(2)“酸浸”时,为了加快反应速率,可采取的措施有
(3)“酸浸”过程中,MnO2发生的主要反应的离子方程式为
(4)常温下,加稀氨水时调pH约为4,则滤渣2的主要成分是
(5)“除杂1”时加入适量的(NH4)2S,除去的主要离子为
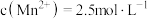 ,则其
,则其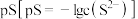 的范围是
的范围是
您最近一年使用:0次
解题方法
2 .  是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。
(1)配合物广泛存在于自然界,其中 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为_______ 。
② 的配位原子是
的配位原子是_______ ,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是_______ 。
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.

Ⅱ.

①反应

_______ 。
②不同温度下氨催化氧化的平衡常数如下(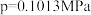 );
);
下列说法正确的是_______ 。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:
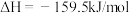
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
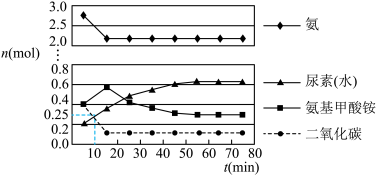
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成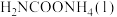 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为_______ 。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是_______ ,第一步反应的平衡常数
_______ (列出算式即可)。
 是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。(1)配合物广泛存在于自然界,其中
 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②
 的配位原子是
的配位原子是(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.


Ⅱ.


①反应


②不同温度下氨催化氧化的平衡常数如下(
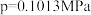 );
);| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( ) ) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( ) ) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.如果对反应不加控制,氨和氧气反应的最终产物主要是

B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:

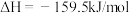
第二步:在体积为5 L的密闭容器中加入1 mol
 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成
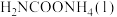 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是

您最近一年使用:0次
名校
解题方法
3 . 稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第ⅢB族,均为金属元素,在工业生产中有重要的作用。回答下列问题:
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共_____ 个,钇(Y)位于元素周期表中钪(Sc)的下一周期,钇(Y)的价电子轨道表达式为_____ 。
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA( )是
)是_____ 齿配位体,EDTA所含元素原子第一电离能由大到小顺序为_____ 。
(3)钪(Sc)离子在水中以稳定对称的 存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为
存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为_____ 。
(4)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中铜原子的杂化类型为_____ (填“ ”或“
”或“ ”)。
”)。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是_____ 。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇( )的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
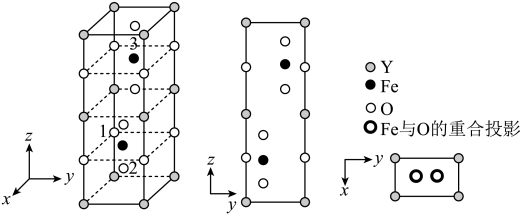
一个晶胞中有_____ 个O。已知1号O原子分数坐标为 ,2号O原子分数坐标为
,2号O原子分数坐标为 ,则3号Fe原子的分数坐标为
,则3号Fe原子的分数坐标为_____ 。
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是(3)钪(Sc)离子在水中以稳定对称的
 存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为
存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为(4)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中铜原子的杂化类型为
 ”或“
”或“ ”)。
”)。②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇(
 )的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
一个晶胞中有
 ,2号O原子分数坐标为
,2号O原子分数坐标为 ,则3号Fe原子的分数坐标为
,则3号Fe原子的分数坐标为
您最近一年使用:0次
4 . C、N化合物对人类生存环境有重要影响。
Ⅰ.汽车尾气中的NO和CO在催化剂作用下可生成无毒无害的气体,工业废气中的NO可被NH3在高温催化作用下还原为N2和H2O。
(1)原子序数为N元素两倍的元素的基态原子的外围电子排布图为_________ 。
(2)C、N、O三种元素的第一电离能由小到大的顺序为_________ 。
(3)键角:NH3__________ (填“>“<”或“=”)H2O;NH3的VSEPR模型为_________ 。
Ⅱ.NO与血红蛋白中的[Fe(H2O)6]2+结合生成[Fe(NO)(H2O)5]2+可导致人体的血红蛋白丧失携氧能力。
(4)Fe2+的配位数为_________ 。
(5)在[Fe(NO)(H2O)5]2+中,配体NO提供配位的原子为_________ (填元素符号),原因是_________ 。
Ⅲ.C元素与N元素形成的一种超硬晶体的晶胞结构如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),设晶胞参数为anm,NA为阿伏加德罗常数的值,1号原子的坐标为(0,0,0)、3号原子的坐标为(1,1,1)。_________ 。
②2号原子的坐标为_________ 。
③该晶体的密度为__________ g/cm3。
Ⅰ.汽车尾气中的NO和CO在催化剂作用下可生成无毒无害的气体,工业废气中的NO可被NH3在高温催化作用下还原为N2和H2O。
(1)原子序数为N元素两倍的元素的基态原子的外围电子排布图为
(2)C、N、O三种元素的第一电离能由小到大的顺序为
(3)键角:NH3
Ⅱ.NO与血红蛋白中的[Fe(H2O)6]2+结合生成[Fe(NO)(H2O)5]2+可导致人体的血红蛋白丧失携氧能力。
(4)Fe2+的配位数为
(5)在[Fe(NO)(H2O)5]2+中,配体NO提供配位的原子为
Ⅲ.C元素与N元素形成的一种超硬晶体的晶胞结构如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),设晶胞参数为anm,NA为阿伏加德罗常数的值,1号原子的坐标为(0,0,0)、3号原子的坐标为(1,1,1)。
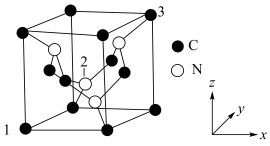
②2号原子的坐标为
③该晶体的密度为
您最近一年使用:0次
2024-03-27更新
|
353次组卷
|
4卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
2024届青海省海东市高三下学期二模理科综合试卷-高中化学2024届陕西省榆林市高三下学期第二次模拟检测理科综合试题-高中化学青海省西宁市湟中区2024届高三下学期一模理综化学试题(已下线)化学(北京卷01)-2024年高考押题预测卷
解题方法
5 . 有机阳离子是一类带正电荷的粒子,如 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。
(1)C原子价电子的轨道表示式为________ 。第一电离能N____ O(填“>”或“<”),原因是__________ 。
(2) 中N的杂化方式为
中N的杂化方式为____________________ 。从化学键的角度描述由 (甲胺)形成
(甲胺)形成 的过程
的过程____________________ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为__________ 。
(4)某材料中含有机阳离子,其晶胞结构如图所示。
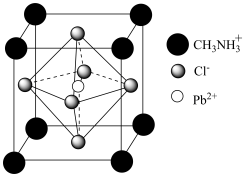
①化学式为____________________ ;其中 周围最临近的
周围最临近的 个数为
个数为__________ 。
②已知晶体密度为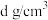 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为______  。
。
 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。(1)C原子价电子的轨道表示式为
(2)
 中N的杂化方式为
中N的杂化方式为 (甲胺)形成
(甲胺)形成 的过程
的过程(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为(4)某材料中含有机阳离子,其晶胞结构如图所示。

①化学式为
 周围最临近的
周围最临近的 个数为
个数为②已知晶体密度为
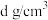 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
6 . 用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
(ⅰ)

(ⅱ)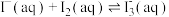
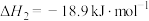
(ⅲ)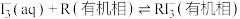

(1)根据盖斯定律,反应

________ 。
(2)基态碘原子价层电子的轨道表示式为________ 。
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[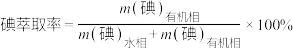 ]曲线如图所示:
]曲线如图所示:_______________ (忽略萃取剂的挥发、 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。
②下列说法不正确的是________ (填标号)。
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释, 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
的浓度,反应(ⅰ)的速率增大
(4)未加萃取剂时,固定总碘浓度为 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
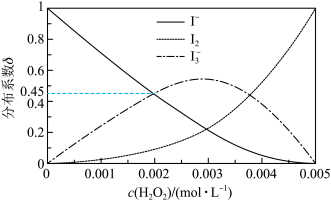
分布系数 与溶液中初始
与溶液中初始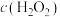 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如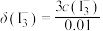 ]
] 、
、 、
、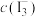 分别为
分别为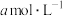 、
、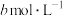 、
、 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为________ 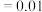 。
。
②计算反应 的平衡常数
的平衡常数
________ (结果保留3位有效数字)。
(5)测定卤水中的 方法:取
方法:取 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用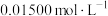
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗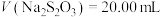 ,则卤水中
,则卤水中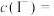
________  。(已知:
。(已知: )
)
 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:(ⅰ)


(ⅱ)
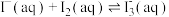
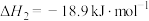
(ⅲ)
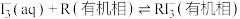

(1)根据盖斯定律,反应


(2)基态碘原子价层电子的轨道表示式为
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[
 ]曲线如图所示:
]曲线如图所示: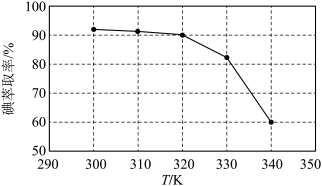
 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。②下列说法不正确的是
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,
 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
的浓度,反应(ⅰ)的速率增大(4)未加萃取剂时,固定总碘浓度为
 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
分布系数 与溶液中初始
与溶液中初始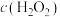 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如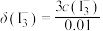 ]
]
 、
、 、
、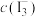 分别为
分别为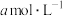 、
、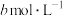 、
、 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为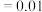 。
。②计算反应
 的平衡常数
的平衡常数
(5)测定卤水中的
 方法:取
方法:取 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用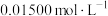
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗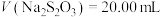 ,则卤水中
,则卤水中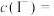
 。(已知:
。(已知: )
)
您最近一年使用:0次
名校
解题方法
7 . 以含钴废渣(主要成分为 和
和 ,含少量铁、铝、锌、硅的氧化物)为原料制备
,含少量铁、铝、锌、硅的氧化物)为原料制备 的工艺如下:
的工艺如下:
(1)基态钴原子的价电子轨道表示式_______________________ ;
(2)“酸浸”中 的主要作用是
的主要作用是__________ ;若 用量过多会造成什么影响:
用量过多会造成什么影响:______________ ;
(3)已知“除杂”中 的浓度为
的浓度为 ,则应调节的
,则应调节的 范围为
范围为__________ ;“滤渣2”的主要成分是___________________ ;
(4)“萃取锌”中可用 (
( ,简写为
,简写为 )作萃取剂。
)作萃取剂。
①酸性强弱:
__________  (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②萃取时若水溶液的酸性太强则萃取率较低,原因是____________________________________ ;
(5)“沉钴”中,若碳酸钠溶液浓度过大或加入速度过快会生成 沉淀,写出生成
沉淀,写出生成 的离子方程式
的离子方程式____________________________________ 。
 和
和 ,含少量铁、铝、锌、硅的氧化物)为原料制备
,含少量铁、铝、锌、硅的氧化物)为原料制备 的工艺如下:
的工艺如下:
氢氧化物 |
|
|
|
|
|
|
|
|
|
(2)“酸浸”中
 的主要作用是
的主要作用是 用量过多会造成什么影响:
用量过多会造成什么影响:(3)已知“除杂”中
 的浓度为
的浓度为 ,则应调节的
,则应调节的 范围为
范围为(4)“萃取锌”中可用
 (
( ,简写为
,简写为 )作萃取剂。
)作萃取剂。①酸性强弱:

 (填“<”、“=”或“>”);
(填“<”、“=”或“>”);②萃取时若水溶液的酸性太强则萃取率较低,原因是
(5)“沉钴”中,若碳酸钠溶液浓度过大或加入速度过快会生成
 沉淀,写出生成
沉淀,写出生成 的离子方程式
的离子方程式
您最近一年使用:0次
2024-03-21更新
|
325次组卷
|
2卷引用:安徽省2024届高三第二次大联考素质测试化学试题
名校
8 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A. B.
B. 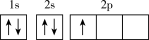
C.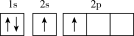 D.
D. 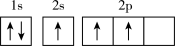
(2)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体,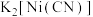 是红黄色单斜晶体。
是红黄色单斜晶体。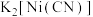 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(3)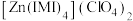 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为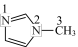 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。
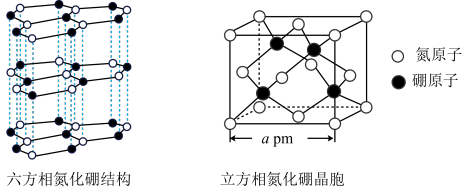
①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(5)红银矿NiAs晶体结构如图所示:
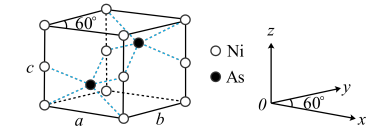
①两个As原子的原子分数坐标依次为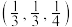 和
和_______ 。
②已知 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体,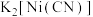 是红黄色单斜晶体。
是红黄色单斜晶体。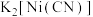 的熔点高于
的熔点高于 的原因是
的原因是(3)
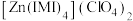 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为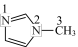 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为
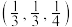 和
和②已知
 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近一年使用:0次
名校
9 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3。工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积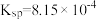 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为______ ;基态Co原子的价层电子轨道表示式为______ 。
(2)“酸浸”时发生反应: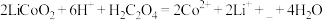 。
。
①补充完整上述离子方程式______ ;
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是______ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中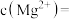
______ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为______ 。
(5)沉锂操作过程中的存在反应: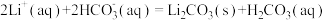 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是______ 。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为______ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为______ pm。

 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
 的溶度积
的溶度积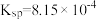 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
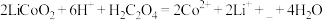 。
。①补充完整上述离子方程式
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是
(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中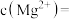
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
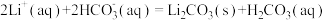 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。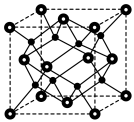
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
您最近一年使用:0次
2024-03-15更新
|
1039次组卷
|
3卷引用:广东省江门市2023-2024学年高三一模考试化学卷
广东省江门市2023-2024学年高三一模考试化学卷广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题 (已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)
10 . 钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为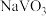 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。 。
。
回答下列问题:
(1)基态铬原子价电子轨道表示式为_______ 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有_______ (任写一点)。
(3)“沉钒”的含钒产物为钒酸钙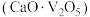 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是_______ 。
(4)“沉铬”时,铬转化为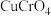 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为_______ 。
(5)向“沉钒后液”中加入足量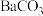 ,可将其中的铬转化为
,可将其中的铬转化为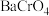 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为_______ (保留三位有效数字) 。
。
(6)复合材料氧铬酸钙的立方晶胞如下图所示。_______ 。
②已知该晶体的密度为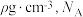 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与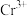 之间的最短距离为
之间的最短距离为_______ 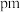 (列出计算式即可)。
(列出计算式即可)。
 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。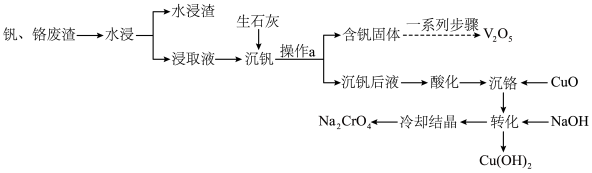
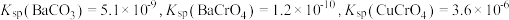 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
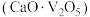 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
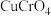 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
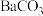 ,可将其中的铬转化为
,可将其中的铬转化为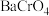 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
②已知该晶体的密度为
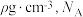 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与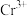 之间的最短距离为
之间的最短距离为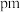 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-02-27更新
|
658次组卷
|
4卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
广东省湛江市2024届高三下学期第二次模拟测试化学试题2024届河南省中原名校高三下学期考前全真模拟考试理科综合试题-高中化学贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)