名校
解题方法
1 . 硼、氮、镁、铝是重要的短周期元素,它们能形成多种重要的化合物。请回答下列问题:
(1)基态Al原子处于最高能级的电子云轮廓图为_______ 形,基态 的核外电子的轨道表达式为
的核外电子的轨道表达式为_______ 。
(2)硼的氢化物叫硼烷( ),如
),如 (乙硼烷)。
(乙硼烷)。 与
与 反应生成
反应生成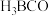 ,
,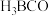 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
(3)离子化合物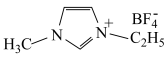 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
①图A、B、C分别表示C、N、O、F的逐级电离能I的变化趋势(纵坐标的标度不同),第一电离能 的变化图是
的变化图是_______ (填序号,下同);第三电离能 的变化图是
的变化图是_______ 。 、
、 和
和 在小立方体中的分布如图2、图3所示。
在小立方体中的分布如图2、图3所示。 的配位数为
的配位数为_______ ,晶体的化学式为_______ 。
②已知 之间的最小间距apm,晶体的密度为d
之间的最小间距apm,晶体的密度为d ,则阿伏加德罗常数的表达式为
,则阿伏加德罗常数的表达式为_______  (用含a、d的式子表示)。
(用含a、d的式子表示)。
(1)基态Al原子处于最高能级的电子云轮廓图为
 的核外电子的轨道表达式为
的核外电子的轨道表达式为(2)硼的氢化物叫硼烷(
 ),如
),如 (乙硼烷)。
(乙硼烷)。 与
与 反应生成
反应生成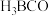 ,
,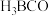 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为(3)离子化合物
 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①图A、B、C分别表示C、N、O、F的逐级电离能I的变化趋势(纵坐标的标度不同),第一电离能
 的变化图是
的变化图是 的变化图是
的变化图是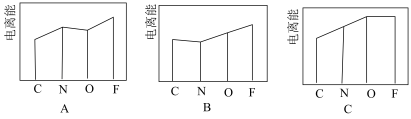
②离子化合物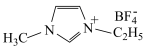 中阳离子存在大
中阳离子存在大 键
键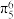 ,该化合物中杂化方式为
,该化合物中杂化方式为 的原子共有
的原子共有
 、
、 和
和 在小立方体中的分布如图2、图3所示。
在小立方体中的分布如图2、图3所示。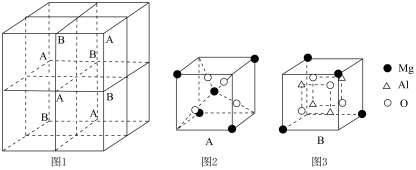
 的配位数为
的配位数为②已知
 之间的最小间距apm,晶体的密度为d
之间的最小间距apm,晶体的密度为d ,则阿伏加德罗常数的表达式为
,则阿伏加德罗常数的表达式为 (用含a、d的式子表示)。
(用含a、d的式子表示)。
您最近一年使用:0次
解题方法
2 . 某合作学习小组将铜片放进氯化铁溶液中,观察到溶液呈无色,产生红褐色固体,铜片表面有白色物质。
Ⅰ.探究红褐色固体成分
(1)过滤得到红褐色固体,所需的仪器有___________ (填标号)。___________ 溶液,溶液变血红色,证明是氢氧化铁。
②产生氢氧化铁的原因可能是___________ (用化学方程式表示)。
Ⅱ.查阅资料:CuCl是白色难溶物
(3)探究产生白色物质的原因。设计实验方案如下:
①由以上实验可知,产生白色物质的条件是___________ 。
②实验2生成白色物质的化学方程式为:___________ 。
③请你从氧化还原反应规律角度分析实验1中未产生白色物质的原因___________ 。
(4)以石墨为电极电解 溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为
溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为___________ 。
(5)基于上述分析,用 溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用
溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用 、KCl、盐酸混合物腐蚀覆铜板,原理为:
、KCl、盐酸混合物腐蚀覆铜板,原理为: 。
。
①基态 的价电子轨道表示式为
的价电子轨道表示式为___________ 。
②KCl的作用是___________ 。
(6)氧化还原反应的应用十分广泛。写出一种氧化剂在生活中的应用___________ 。
Ⅰ.探究红褐色固体成分
(1)过滤得到红褐色固体,所需的仪器有
②产生氢氧化铁的原因可能是
Ⅱ.查阅资料:CuCl是白色难溶物
(3)探究产生白色物质的原因。设计实验方案如下:
| 实验 | 铜粉/g |  /g /g | 蒸馏水/mL | 实验现象 |
| 1 | 0.1 | 1.8 | 2 | 棕黄色溶液变为墨绿色 |
| 2 | 0.5 | 1.8 | 2 | 棕黄色溶液变为白色浊液 |
②实验2生成白色物质的化学方程式为:
③请你从氧化还原反应规律角度分析实验1中未产生白色物质的原因
(4)以石墨为电极电解
 溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为
溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为(5)基于上述分析,用
 溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用
溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用 、KCl、盐酸混合物腐蚀覆铜板,原理为:
、KCl、盐酸混合物腐蚀覆铜板,原理为: 。
。①基态
 的价电子轨道表示式为
的价电子轨道表示式为②KCl的作用是
(6)氧化还原反应的应用十分广泛。写出一种氧化剂在生活中的应用
您最近一年使用:0次
名校
解题方法
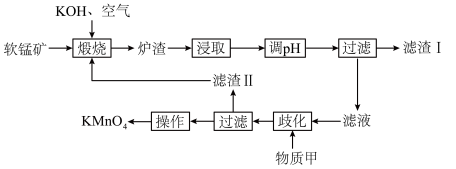
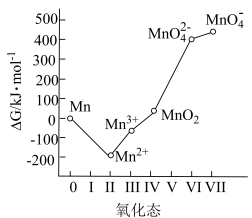
3 . 高锰酸钾为常见的强氧化剂,常用于消毒杀菌。工业上常以软锰矿(主要成分为MnO2,含少量Si、Al的氧化物)为原料制备,流程如下:
回答下列问题:
(1)基态Mn2+的价电子轨道表示式为___________ 。K2MnO4中Mn的化合价为___________ 。
(2)煅烧后,炉渣主要成分为K2MnO4,写出MnO2发生的化学方程式___________ 。
(3)浸取后通入CO2调节pH,则滤渣Ⅰ的主要成分为___________ 、___________ 。
(4)流程中的“歧化”可加入的物质甲是___________(填字母)。
(5)歧化时发生的离子方程式为___________ 。
(6)实验室常用草酸标准溶液测定产品中高锰酸钾的纯度。取0.5000g样品溶于水,配成100mL溶液,取10.00mL于锥形瓶中,滴入5滴稀硫酸酸化,用0.1500mol/L草酸标准溶液滴定,达终点时消耗标准液5.100mL。
①滴定终点的现象为___________ 。
②样品中高锰酸钾(摩尔质量为158g·mol-1)的纯度为___________ %(结果保留小数点后两位)。
回答下列问题:
(1)基态Mn2+的价电子轨道表示式为
(2)煅烧后,炉渣主要成分为K2MnO4,写出MnO2发生的化学方程式
(3)浸取后通入CO2调节pH,则滤渣Ⅰ的主要成分为
(4)流程中的“歧化”可加入的物质甲是___________(填字母)。
| A.亚硫酸 | B.浓盐酸 | C.乙二酸 | D.稀硫酸 |
(5)歧化时发生的离子方程式为
(6)实验室常用草酸标准溶液测定产品中高锰酸钾的纯度。取0.5000g样品溶于水,配成100mL溶液,取10.00mL于锥形瓶中,滴入5滴稀硫酸酸化,用0.1500mol/L草酸标准溶液滴定,达终点时消耗标准液5.100mL。
①滴定终点的现象为
②样品中高锰酸钾(摩尔质量为158g·mol-1)的纯度为
您最近一年使用:0次
解题方法
4 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近一年使用:0次
解题方法
5 . 铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为
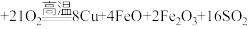 。回答下列问题:
。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为______________ ,基态铜原子核外电子的空间运动状态(原子轨道)有__________ 种。
(2)高温下CuO能转化为 的原因是
的原因是_____________ (从原子结构角度分析)。
(3) 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________ ,属于极性分子的是___________ , 、
、 、
、 、
、 四种含硫微粒的空间结构分别为
四种含硫微粒的空间结构分别为____________ 、____________ 、____________ 、____________ 。
(4) 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是_______________ ,1360℃是__________ 的熔点。
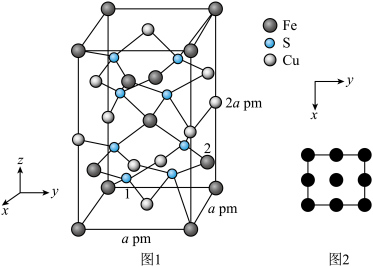
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为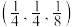 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为____________ 。晶胞参数分别为a pm,a pm、2a pm, 晶体的密度为
晶体的密度为___________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。

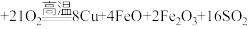 。回答下列问题:
。回答下列问题:(1)基态铜原子的价层电子的轨道表示式(电子排布图)为
(2)高温下CuO能转化为
 的原因是
的原因是(3)
 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是 、
、 、
、 、
、 四种含硫微粒的空间结构分别为
四种含硫微粒的空间结构分别为(4)
 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为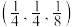 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 晶体的密度为
晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
6 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al、C等)制备Co2O3和Li2CO3。工艺流程如下:
①已知LiCoO2难溶于水,酸浸后的溶液中含有的部分金属离子有:Co2+、Fe2+、Al3+、Mg2+等;
②NaHCO3溶液中存在 的自耦电离:
的自耦电离: ;
;
③常温时,有关物质Ksp如下表:
(1)为了使拆解后的“正极材料”与酸充分反应,可采取的措施有___________ (任写一种)。
(2)元素Co在周期表中的位置为___________ ;Co2+价层电子轨道表示式为___________ 。
(3)“酸浸”时,LiCoO2参与反应的离子方程式为___________ ;下列试剂中最适宜替换H2C2O4的是___________ 。
A.Na2CO3溶液 B.Na2S2O5溶液 C.NaNO3溶液 D.浓盐酸
(4)滤渣1的主要成分有___________ 。
(5)加NaOH调节pH=10时,可以完全沉淀的金属离子有___________ (一般认为离子浓度≤10-5mol/L时,离子沉淀完全)。
(6)滤液3中含金属元素的离子主要是 ,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为
,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为___________ 。
(7)沉锂操作过程中需将温度升高到90℃,原因①是加快反应速率,并降低Li2CO3的溶解度②是(结合平衡原理解释)___________ 。

①已知LiCoO2难溶于水,酸浸后的溶液中含有的部分金属离子有:Co2+、Fe2+、Al3+、Mg2+等;
②NaHCO3溶液中存在
 的自耦电离:
的自耦电离: ;
;③常温时,有关物质Ksp如下表:
| 物质 |  |  |  |  |
| Ksp | 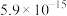 |  | 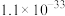 |  |
(1)为了使拆解后的“正极材料”与酸充分反应,可采取的措施有
(2)元素Co在周期表中的位置为
(3)“酸浸”时,LiCoO2参与反应的离子方程式为
A.Na2CO3溶液 B.Na2S2O5溶液 C.NaNO3溶液 D.浓盐酸
(4)滤渣1的主要成分有
(5)加NaOH调节pH=10时,可以完全沉淀的金属离子有
(6)滤液3中含金属元素的离子主要是
 ,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为
,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为(7)沉锂操作过程中需将温度升高到90℃,原因①是加快反应速率,并降低Li2CO3的溶解度②是(结合平衡原理解释)
您最近一年使用:0次
7 . 镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备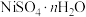 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。
 (水相)+2RH(有机相)
(水相)+2RH(有机相)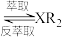 (有机相)
(有机相) (水相)
(水相)
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________ (填元素符号)。原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,“
”表示,“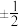 ”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为________ 。
(2)已知NiO与MgO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO________ MgO(填“>”“<”或“=”),理由是________ 。
(3)滤渣1的主要成分为________ (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是________ 。
(5)反萃取剂A为________ 。
(6)“反萃取”得到的 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为________ 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、________ 、过滤、洗涤、干燥。
 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备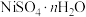 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。
 (水相)+2RH(有机相)
(水相)+2RH(有机相)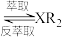 (有机相)
(有机相) (水相)
(水相)回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,“
”表示,“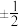 ”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为(2)已知NiO与MgO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO(3)滤渣1的主要成分为
(4)电解之后加入碳酸钠调节pH的目的是
(5)反萃取剂A为
(6)“反萃取”得到的
 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
晶体形态 |
|
| 多种结晶水合物 |
|
 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、
您最近一年使用:0次
名校
解题方法
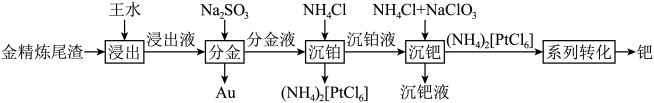
8 . 用铜阳极泥进行金银提取,精炼过程产生的金精炼尾渣中含有多种贵金属,一种从金精炼尾渣中回收金(Au)、铂(Pt)、钯(Pd)的工艺流程如下: 、
、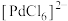 、
、 、
、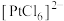 。
。
回答下列问题:
(1)“浸出”时,为提高金精炼尾渣的浸出速率,可采取的措施有___________ (任写两条)。
(2)“浸出”时,所用王水的组成及体积比为___________ 。
(3)“分金”时,生成金单质的离子方程式为___________ ;金位于元素周期表的第六周期第ⅠB族,则基态金原子的价层电子轨道表示式为___________ 。
(4)“沉铂”时,得到的 经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为
经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为___________ 。
(5)“沉钯”时,加入氯酸钠的目的为___________ 。
(6)“系列转化”涉及的部分转化如下:
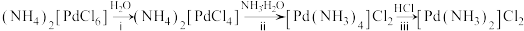
该过程中Pd有___________ 种不同的配位数,配位能力
___________  (填“>”或“<”);ⅲ中发生反应的化学方程式为
(填“>”或“<”);ⅲ中发生反应的化学方程式为___________ 。
 、
、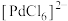 、
、 、
、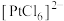 。
。回答下列问题:
(1)“浸出”时,为提高金精炼尾渣的浸出速率,可采取的措施有
(2)“浸出”时,所用王水的组成及体积比为
(3)“分金”时,生成金单质的离子方程式为
(4)“沉铂”时,得到的
 经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为
经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为(5)“沉钯”时,加入氯酸钠的目的为
(6)“系列转化”涉及的部分转化如下:
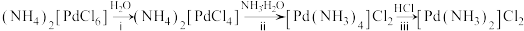
该过程中Pd有

 (填“>”或“<”);ⅲ中发生反应的化学方程式为
(填“>”或“<”);ⅲ中发生反应的化学方程式为
您最近一年使用:0次
2024-04-19更新
|
232次组卷
|
3卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高三下学期4月模拟测试化学试题
解题方法
9 . 钴(Co)和铜(Cu)是生命体必需的微量元素,且在材料、医药等领域具有广泛应用。回答下列问题:
(1)Cu-Ni-Co-Si合金具有较高的导电、导热性和良好的加工、耐蚀性,是很有发展潜力的材料。
①基态Cu原子的最外层电子轨道表示式为___________ 。
②电解熔融的CoCl2或CoO都能制备金属钴。CoCl2的熔点(735℃)低于CoO的熔点(1935℃)的原因是___________ 。
(2)含金属钴和一氧化碳配体的羧基钴配合物具有抗肿瘤和抗炎的潜力。一种羰基钴配合物的合成路线如下:___________ 。固体I中存在的作用力除共价键外,还有___________ 。1mol I中含有的σ键数目为___________ 。
②化合物Ⅱ分子中原子的杂化方式有___________ 。
③配合物Ⅲ中,配体一氧化碳的配位原子为___________ ,写出一个与CO互为等电子体的阴离子___________ 。
(3)Cu-Mn-Al合金的晶胞如a图所示,该晶胞可视为Mn,Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。___________ 。
②已知原子半径: ,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为
,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为___________ pm。
(1)Cu-Ni-Co-Si合金具有较高的导电、导热性和良好的加工、耐蚀性,是很有发展潜力的材料。
①基态Cu原子的最外层电子轨道表示式为
②电解熔融的CoCl2或CoO都能制备金属钴。CoCl2的熔点(735℃)低于CoO的熔点(1935℃)的原因是
(2)含金属钴和一氧化碳配体的羧基钴配合物具有抗肿瘤和抗炎的潜力。一种羰基钴配合物的合成路线如下:

②化合物Ⅱ分子中原子的杂化方式有
③配合物Ⅲ中,配体一氧化碳的配位原子为
(3)Cu-Mn-Al合金的晶胞如a图所示,该晶胞可视为Mn,Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。

②已知原子半径:
 ,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为
,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为
您最近一年使用:0次
名校
解题方法
10 . 中医药学认为,雄黄(As4S4),外用可以治疗疥癣恶疮、蛇虫咬伤等;微量内服,可治惊痫、疮毒等症。雄黄遇热易氧化为As2O3(俗称砒霜),虽在古时常用做毒药,但科学家却发现它对治疗白血病有明显的作用。砷的其它化合物也在研究和生产中有着许多重要用途。____ ,核外电子占据的最高能级的电子云轮廓图形状为____ 。
(2)雄黄(As4S4)的结构如上图1所示,As原子的杂化形式为_____ 。
(3)Na3AsO4常用作杀虫剂、防腐剂,它含有的化学键类型包括____ ;AsO43-的空间构型为_____ 。
(4)砷化镓是优良的半导体材料,其晶胞结构如图2所示。立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是____ ;砷化镓密度为 ,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为
,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为 ,则砷化镓晶体的空间利用率为
,则砷化镓晶体的空间利用率为_____ 。
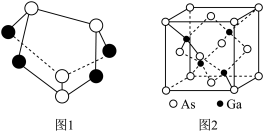
(2)雄黄(As4S4)的结构如上图1所示,As原子的杂化形式为
(3)Na3AsO4常用作杀虫剂、防腐剂,它含有的化学键类型包括
(4)砷化镓是优良的半导体材料,其晶胞结构如图2所示。立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是
 ,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为
,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为 ,则砷化镓晶体的空间利用率为
,则砷化镓晶体的空间利用率为
您最近一年使用:0次




