1 . 锌的配合物在工业中有着重要应用。回答下列问题:
(1)一种锌的配合物M的结构如图1。___________ 区。M分子中元素电负性最大的原子处于基态时,其价电子排布图为___________ 。 构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。
构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。 中氧原子的轨道杂化方式为
中氧原子的轨道杂化方式为________ , 的配位数为
的配位数为_________ 。
②晶体内部空腔可吸附小分子,要增强晶体与 的吸附作用,可在对苯二甲酸根上引入
的吸附作用,可在对苯二甲酸根上引入________ (假设晶胞形状不变)。
A.—Cl B.—OH C. D.
D.
③已知该晶体密度为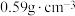 ,对苯二甲酸根与
,对苯二甲酸根与 的相对分子质量分别为
的相对分子质量分别为 和
和 ,
, 为阿伏加德罗常数的值,则该晶胞参数为
为阿伏加德罗常数的值,则该晶胞参数为___________ nm(用含 、
、 和
和 的式子表示)。
的式子表示)。
(1)一种锌的配合物M的结构如图1。
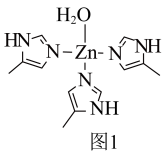
②已知配体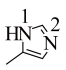 中的五元环为平面结构,则形成大
中的五元环为平面结构,则形成大 键时1号氮原子提供的电子数
键时1号氮原子提供的电子数 ”、“
”、“ ”或“
”或“ ”)2号氮原子提供的电子数;该分子具有碱性,原因是
”)2号氮原子提供的电子数;该分子具有碱性,原因是
 构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。
构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。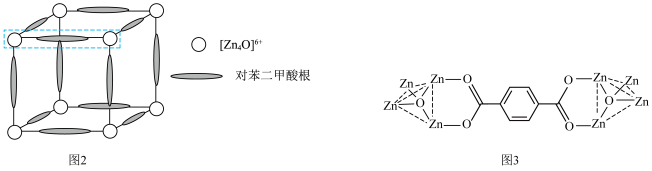
 中氧原子的轨道杂化方式为
中氧原子的轨道杂化方式为 的配位数为
的配位数为②晶体内部空腔可吸附小分子,要增强晶体与
 的吸附作用,可在对苯二甲酸根上引入
的吸附作用,可在对苯二甲酸根上引入A.—Cl B.—OH C.
 D.
D.
③已知该晶体密度为
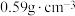 ,对苯二甲酸根与
,对苯二甲酸根与 的相对分子质量分别为
的相对分子质量分别为 和
和 ,
, 为阿伏加德罗常数的值,则该晶胞参数为
为阿伏加德罗常数的值,则该晶胞参数为 、
、 和
和 的式子表示)。
的式子表示)。
您最近一年使用:0次
2 . 以钛铁矿(主要成分为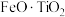 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如图所示:
)的工艺流程如图所示:
(1)基态Ti原子价层电子轨道表示式为___________ 。
(2)“溶浸”后溶液中阳离子有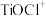 、
、 、
、___________ ,加热水解后转化为富钛渣(钛元素主要以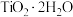 ),写出上述转变的离子方程式:
),写出上述转变的离子方程式:___________ 。
(3)“溶钛”过程中Ti元素的浸出率随温度变化如图所示,随温度升高Ti元素浸出率下降的原因是___________ 。 的化学反应方程式是
的化学反应方程式是___________ 。
(5)“沉铁”后的滤液经处理后可返回___________ 工序中循环利用;“沉铁”时当 完全沉淀时,
完全沉淀时, 的浓度为
的浓度为___________  。(已知:若溶液中离子浓度小于
。(已知:若溶液中离子浓度小于 时,认为该离子完全沉淀。
时,认为该离子完全沉淀。 )
)
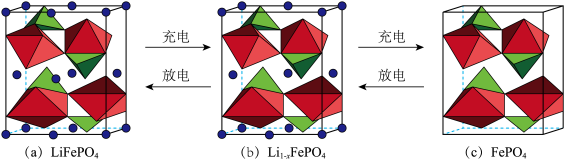
(6)磷酸铁锂材料被认为是动力锂离子电池比较理想的正极材料,其充放电过程如图所示,充电时,1mol 完全形成
完全形成 ,脱出amol的
,脱出amol的 ,则
,则
___________ 。
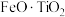 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如图所示:
)的工艺流程如图所示: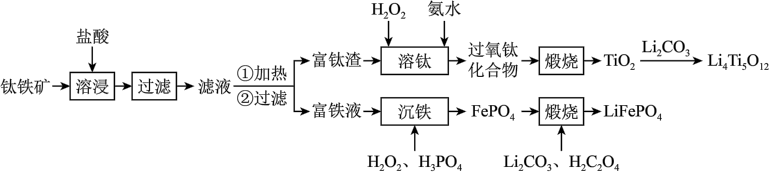
(1)基态Ti原子价层电子轨道表示式为
(2)“溶浸”后溶液中阳离子有
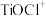 、
、 、
、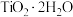 ),写出上述转变的离子方程式:
),写出上述转变的离子方程式:(3)“溶钛”过程中Ti元素的浸出率随温度变化如图所示,随温度升高Ti元素浸出率下降的原因是

 的化学反应方程式是
的化学反应方程式是(5)“沉铁”后的滤液经处理后可返回
 完全沉淀时,
完全沉淀时, 的浓度为
的浓度为 。(已知:若溶液中离子浓度小于
。(已知:若溶液中离子浓度小于 时,认为该离子完全沉淀。
时,认为该离子完全沉淀。 )
)(6)磷酸铁锂材料被认为是动力锂离子电池比较理想的正极材料,其充放电过程如图所示,充电时,1mol
 完全形成
完全形成 ,脱出amol的
,脱出amol的 ,则
,则
您最近一年使用:0次
3 . 国产巨型载人飞艇AS700、歼20战机和C919国产大飞机等大国重器让世界瞩目。金属材料和复合材料在航空航天工业中具有重要的应用。回答下列问题:
(1)基态钛原子价层电子排布图为______ 。原子中运动电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的则用
表示,与之相反的则用 表示,称为电子的自旋磁量子数。对于基态钛原子,其价层电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价层电子自旋磁量子数的代数和为______ 。
(2)以 为连续基体的碳陶瓷是一种复合材料,可应用于制造歼20。结构如图所示:
为连续基体的碳陶瓷是一种复合材料,可应用于制造歼20。结构如图所示:______ (填标号)。 晶体中硅原子与最近碳原子间距离为
晶体中硅原子与最近碳原子间距离为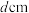 ,则硅原子与最近的硅原子间距离为
,则硅原子与最近的硅原子间距离为______  ,一个硅原子周围与其最近的硅原子的数目为
,一个硅原子周围与其最近的硅原子的数目为______ 。 晶体的密度为
晶体的密度为______  (用含有
(用含有 的式子表示)。
的式子表示)。
(1)基态钛原子价层电子排布图为
 表示,与之相反的则用
表示,与之相反的则用 表示,称为电子的自旋磁量子数。对于基态钛原子,其价层电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价层电子自旋磁量子数的代数和为(2)以
 为连续基体的碳陶瓷是一种复合材料,可应用于制造歼20。结构如图所示:
为连续基体的碳陶瓷是一种复合材料,可应用于制造歼20。结构如图所示:
a.  b.
b.
c.  d.
d.
 晶体中硅原子与最近碳原子间距离为
晶体中硅原子与最近碳原子间距离为 ,则硅原子与最近的硅原子间距离为
,则硅原子与最近的硅原子间距离为 ,一个硅原子周围与其最近的硅原子的数目为
,一个硅原子周围与其最近的硅原子的数目为 晶体的密度为
晶体的密度为 (用含有
(用含有 的式子表示)。
的式子表示)。
您最近一年使用:0次
4 . 单团簇催化剂(SCCs)是指由多个金属原子组成的亚纳米小颗粒,对其结构、性能、应用的研究具有广阔的前景。
(1)某SCCs的结构如下:
反应i.2NO(g)+2H2(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;
反应ii.2NO(g)+5H2(g) 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。
则NH3(g)
 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=________ kJ·mol-1。
(3)在 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如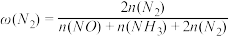 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。________ 、____ 。(填“ ”“
”“ ”或“
”或“ ”)
”)
②若选择对反应ii催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应i的平衡常数 =
=____ kPa-1(列出计算式即可,平衡时分压代替平衡浓度)。
(1)某SCCs的结构如下:
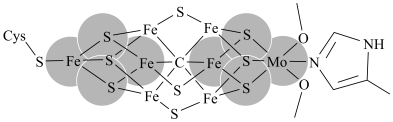
Cys的结构简式为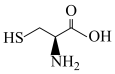 ,其组成元素中电负性从大到小依次是
,其组成元素中电负性从大到小依次是
反应i.2NO(g)+2H2(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;反应ii.2NO(g)+5H2(g)
 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。则NH3(g)

 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=(3)在
 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如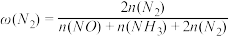 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。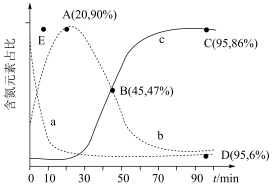
 ”“
”“ ”或“
”或“ ”)
”)②若选择对反应ii催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应i的平衡常数
 =
=
您最近一年使用:0次
5 . 铜是人类最早发现的金属之一,铜及其化合物在生活和生产中有着广泛的应用。根据信息回答下列问题:
(1)基态铜原子价层电子的轨道表达式为__________ 。
(2)农药波尔多液的有效杀菌成分是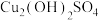 (碱式硫酸铜),
(碱式硫酸铜),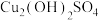 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是__________ ,写出与 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式__________ 。
(3)氨缩脲( )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为__________ , 键与
键与 键的数目之比为
键的数目之比为__________ 。氨缩脲与胆矾溶液反应得到如图所示的离子, 该离子中含配位键的数目为
该离子中含配位键的数目为__________ 。
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为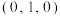 。原子B的坐标参数为
。原子B的坐标参数为__________ ;若该晶体密度为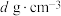 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为__________ pm。
(1)基态铜原子价层电子的轨道表达式为
(2)农药波尔多液的有效杀菌成分是
 (碱式硫酸铜),
(碱式硫酸铜),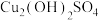 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式(3)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为 键与
键与 键的数目之比为
键的数目之比为 该离子中含配位键的数目为
该离子中含配位键的数目为
A. | B. |
C. | D. |
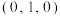 。原子B的坐标参数为
。原子B的坐标参数为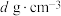 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为
您最近一年使用:0次
解题方法
6 . 废 催化剂(含
催化剂(含 、
、 、
、 等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。 、
、 和
和 都能与NaOH溶液反应生成可溶性的
都能与NaOH溶液反应生成可溶性的 、
、 和不溶性的
和不溶性的 ;②
;② 易水解;③
易水解;③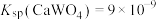 。
。
回答下列问题:
(1)基态钒原子的价层电子轨道表示式为:___________ 。
(2)碱浸步骤可以提高浸取率的操作有___________ (列举两项)。
(3)碱浸后可通过减压过滤的方式分离Ti与V、W,减压过滤的优点是___________ 。
(4)酸浸后Ti以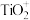 形式存在,热水解步骤的离子方程式为
形式存在,热水解步骤的离子方程式为___________ 。
(5)“沉钒”中析出 时,需要加入过量
时,需要加入过量 ,其目的是
,其目的是___________ 。
(6)向10mL0.1mol/L 的滤液中加入等体积的
的滤液中加入等体积的 溶液(忽略混合过程中的体积变化),欲使
溶液(忽略混合过程中的体积变化),欲使 浓度小于
浓度小于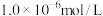 ,则
,则 溶液的最小浓度为
溶液的最小浓度为___________ mol/L。
(7)铝热法常用于冶炼高熔点金属,写出铝热法冶炼W的化学方程式___________ 。
 催化剂(含
催化剂(含 、
、 、
、 等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。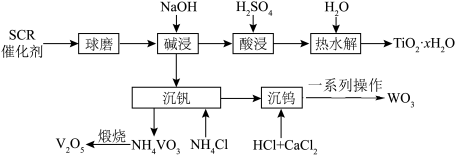
 、
、 和
和 都能与NaOH溶液反应生成可溶性的
都能与NaOH溶液反应生成可溶性的 、
、 和不溶性的
和不溶性的 ;②
;② 易水解;③
易水解;③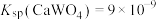 。
。回答下列问题:
(1)基态钒原子的价层电子轨道表示式为:
(2)碱浸步骤可以提高浸取率的操作有
(3)碱浸后可通过减压过滤的方式分离Ti与V、W,减压过滤的优点是
(4)酸浸后Ti以
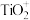 形式存在,热水解步骤的离子方程式为
形式存在,热水解步骤的离子方程式为(5)“沉钒”中析出
 时,需要加入过量
时,需要加入过量 ,其目的是
,其目的是(6)向10mL0.1mol/L
 的滤液中加入等体积的
的滤液中加入等体积的 溶液(忽略混合过程中的体积变化),欲使
溶液(忽略混合过程中的体积变化),欲使 浓度小于
浓度小于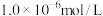 ,则
,则 溶液的最小浓度为
溶液的最小浓度为(7)铝热法常用于冶炼高熔点金属,写出铝热法冶炼W的化学方程式
您最近一年使用:0次
7 . 工业上,从铜镍矿(主要成分为铜氧化物、镍氧化物,含有 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下:
②当溶液中某离子浓度c≤10-5mol/L时,可认为该离子沉淀完全。
③
(1)基态 原子的价电子排布图为
原子的价电子排布图为___________ 。
(2)浸出过程中通入 的目的是
的目的是___________ 。
(3)萃取时发生反应: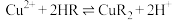 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。___________ 。
(4)写出用惰性电极电解 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:___________ 。
(5)黄钠铁矾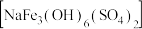 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是___________ 。
(6)第二次使用 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至___________ (保留2位小数)。
 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下: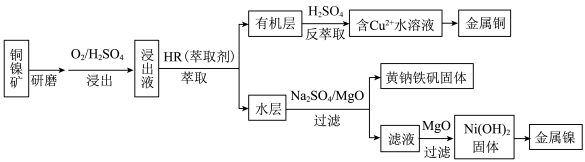
| 物质 |  |  |  |  |
 |  |  |  | 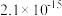 |
③

(1)基态
 原子的价电子排布图为
原子的价电子排布图为(2)浸出过程中通入
 的目的是
的目的是(3)萃取时发生反应:
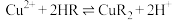 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。①某种 的结构简式为
的结构简式为 ,该分子中可能与
,该分子中可能与 形成配位键的原子有
形成配位键的原子有
(4)写出用惰性电极电解
 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:(5)黄钠铁矾
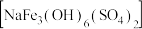 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是(6)第二次使用
 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至
您最近一年使用:0次
8 . 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备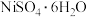 和
和 的工艺流程如下。
的工艺流程如下。
(1)基态Co原子的价层电子的轨道表示式为___________ 。
(2)“滤渣Ⅰ”主要成分是___________ (填化学式)。
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为___________ 。
(4)“萃取”时需充分振荡,目的是___________ 。“萃取”和“反萃取”可简单表示为: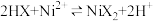 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是___________ 。“反萃取”需要往有机层中加___________ (填试剂名称)。
(5)常温下,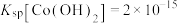 ,若起始时
,若起始时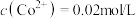 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<___________ 。
(6) 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在___________ ℃(填范围)煅烧至恒重即可得到 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为___________ 。
 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备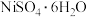 和
和 的工艺流程如下。
的工艺流程如下。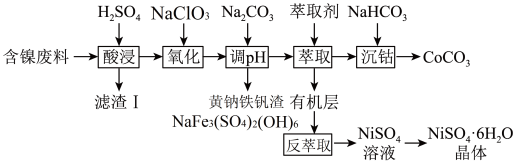
(1)基态Co原子的价层电子的轨道表示式为
(2)“滤渣Ⅰ”主要成分是
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为
(4)“萃取”时需充分振荡,目的是
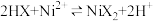 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是(5)常温下,
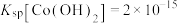 ,若起始时
,若起始时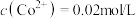 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<(6)
 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。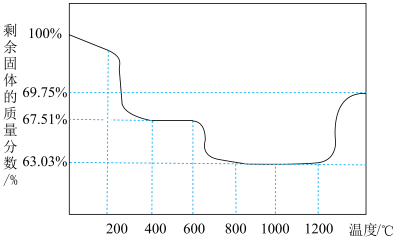
 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为
您最近一年使用:0次
9 . 铁、钴、镍位于元素周期表中第四周期第Ⅷ族,它们的单质及其化合物在化工生产中用途广泛.回答下列问题:
(1)基态铁原子价电子排布图为________________ ;第四周期元素中基态原子未成对电子数与钴相同的还有________ (填元素符号);
(2)向含 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;
①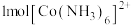 中含有
中含有 键的物质的量为
键的物质的量为________ ; 中存在
中存在________ (填选项字母);
A. 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键
②与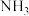 相比,
相比, 中的
中的
________ (填“较大”或“较小”),原因为________________ ;
③ 被氧化为
被氧化为 的离子方程式为
的离子方程式为________________ ;
(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为________ ;设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为________ 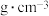 (列出计算式即可);
(列出计算式即可);
(1)基态铁原子价电子排布图为
(2)向含
 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;①
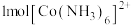 中含有
中含有 键的物质的量为
键的物质的量为 中存在
中存在A.
 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键②与
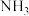 相比,
相比, 中的
中的
③
 被氧化为
被氧化为 的离子方程式为
的离子方程式为(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为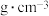 (列出计算式即可);
(列出计算式即可);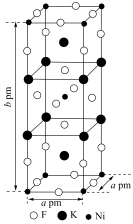
您最近一年使用:0次
10 . 刀片电池是比亚迪发布的新型电池产品,该电池采用磷酸铁锂技术,以硫铁矿烧渣(主要成分 、
、 、
、 、CaO、
、CaO、 )为原料制备
)为原料制备 的流程如下图所示:
的流程如下图所示: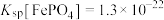 ,
,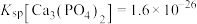 ;当溶液中离子浓度小于或等于
;当溶液中离子浓度小于或等于 时认为沉淀完全。
时认为沉淀完全。
请回答下列问题:
(1) 的价电子轨道表示式为
的价电子轨道表示式为______ ;磷酸根离子的空间构型为______ 。
(2)滤渣1的主要成分有______ (填化学式)。
(3)①“氧化”工序的目的是______ ;
②检验“氧化”工序是否完全的实验操作为______ ;
③“氧化”过程中主要发生的离子方程式为______ 。
(4)已知“氧化”后的溶液中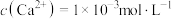 ,“沉铁”过程中,当
,“沉铁”过程中,当 恰好完全沉淀时,溶液中残留的
恰好完全沉淀时,溶液中残留的 是否会沉淀,写出计算过程
是否会沉淀,写出计算过程______ 。
(5)“煅烧还原”工序中发生反应的化学方程式为______ 。
 、
、 、
、 、CaO、
、CaO、 )为原料制备
)为原料制备 的流程如下图所示:
的流程如下图所示: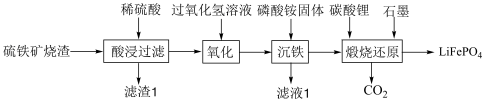
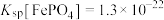 ,
,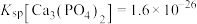 ;当溶液中离子浓度小于或等于
;当溶液中离子浓度小于或等于 时认为沉淀完全。
时认为沉淀完全。请回答下列问题:
(1)
 的价电子轨道表示式为
的价电子轨道表示式为(2)滤渣1的主要成分有
(3)①“氧化”工序的目的是
②检验“氧化”工序是否完全的实验操作为
③“氧化”过程中主要发生的离子方程式为
(4)已知“氧化”后的溶液中
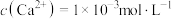 ,“沉铁”过程中,当
,“沉铁”过程中,当 恰好完全沉淀时,溶液中残留的
恰好完全沉淀时,溶液中残留的 是否会沉淀,写出计算过程
是否会沉淀,写出计算过程(5)“煅烧还原”工序中发生反应的化学方程式为
您最近一年使用:0次



