解题方法
1 . 氮元素对人类生命和生活具有重要意义。氮及其化合物在工业生产和国防建设中有广泛的应用。回答以下问题:
(1)基态N原子的核外电子排布图为___________ 。
(2)氮族元素氢化物RH3 (NH3、PH3、AsH3) 的某种性质随R的核电荷数的变化趋势如图所示。Y轴可表示的氢化物(RH3)性质可能是___________ 。
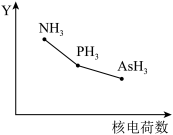
a.沸点 b.稳定性 c. R-H键能 d.分子间作用力
(3)酞菁钴是光动力学中的光敏剂,结构如图甲所示。其组成元素的电负性由大到小的顺序为___________ , N原子的杂化轨道类型为___________ 。
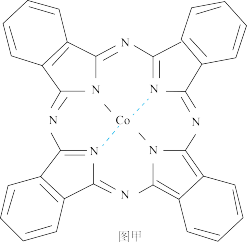
(4)氨盐大多不稳定,NH4F与NH4I中,较易分解的是___________ ;原因为___________ 。
(5)Cr-N系列涂层具有良好的耐磨和腐蚀性,在抗微动磨损上表现尤佳。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图乙所示:
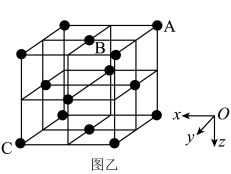
①下列为晶胞中Cr原子沿x轴方向的投影的是___________ (填字母)。
a. b.
b.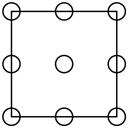 c.
c.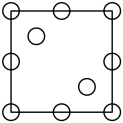 d.
d.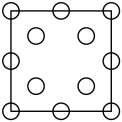
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为a nm和b nm;晶胞中N原子的坐标是A(0,0, 0)、 B( ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是___________ ;设阿伏伽德罗常数的值为NA,则该氮化铬晶体的密度 ρ=___________ g·cm-3(用含a、b、NA的代数式表示)。
(1)基态N原子的核外电子排布图为
(2)氮族元素氢化物RH3 (NH3、PH3、AsH3) 的某种性质随R的核电荷数的变化趋势如图所示。Y轴可表示的氢化物(RH3)性质可能是

a.沸点 b.稳定性 c. R-H键能 d.分子间作用力
(3)酞菁钴是光动力学中的光敏剂,结构如图甲所示。其组成元素的电负性由大到小的顺序为

(4)氨盐大多不稳定,NH4F与NH4I中,较易分解的是
(5)Cr-N系列涂层具有良好的耐磨和腐蚀性,在抗微动磨损上表现尤佳。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图乙所示:

①下列为晶胞中Cr原子沿x轴方向的投影的是
a.
 b.
b. c.
c. d.
d.
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为a nm和b nm;晶胞中N原子的坐标是A(0,0, 0)、 B(
 ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是
您最近一年使用:0次
2 . 铋及其化合物在工业生产中用途广泛,如氯氧化铋(BiOCl)常用作电子设备、塑料助剂等。以下是一种用铋精矿(Bi2S3,含有FeS2、Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图:
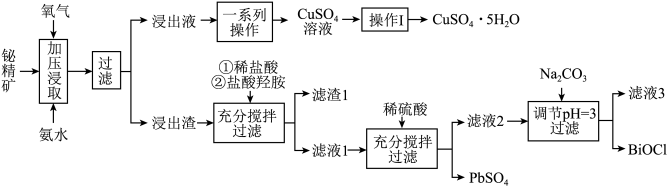
已知:
① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)Cu的基态核外价电子排布图为___________
(2)铋精矿在浸取时除采用粉碎矿石和增大压强来提高铋精矿浸取率外,还可以采取___________ 、___________ 措施(任写两条)。
(3)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为SO ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:___________
(4)“操作Ⅰ”为___________ 、过滤、洗涤、干燥。
(5)流程中生成 BiOCl 的离子方程式:___________
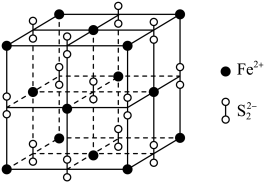
(6)FeS2的立方晶胞结构如图所示。已知晶胞的参数为a pm,设NA为阿伏加德罗常数的值,则该晶体中与Fe2+距离最近且相等的Fe2+有___________ 个,该晶胞的密度为___________ g/cm3(列出计算式)

已知:
① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)Cu的基态核外价电子排布图为
(2)铋精矿在浸取时除采用粉碎矿石和增大压强来提高铋精矿浸取率外,还可以采取
(3)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为SO
 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:(4)“操作Ⅰ”为
(5)流程中生成 BiOCl 的离子方程式:
(6)FeS2的立方晶胞结构如图所示。已知晶胞的参数为a pm,设NA为阿伏加德罗常数的值,则该晶体中与Fe2+距离最近且相等的Fe2+有

您最近一年使用:0次
解题方法
3 . 镍电池广泛应用于混合动力汽车系统,电极材料由 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
已知:a. 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。
b.实验温度时的溶解度:
c.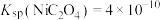
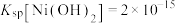
d.实验温度下相关金属离子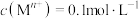 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)加入盐酸溶液所得残渣的主要成分为___________ (填物质名称)。
(2)根据信息判断步骤②先析出的沉淀Ⅱ为___________ (填化学式),控制两种沉淀析出可利用___________ (填序号)。
A. 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂
(3)该工艺流程中多次重复利用的一种实验基本操作是___________ ,可以循环使用的物质是___________ (填化学式)。
(4) 的价电子轨道表示式为
的价电子轨道表示式为___________ ,N、O、S的电负性由大到小的顺序为___________ ,硫氰酸分子 中
中 键和
键和 键之比为
键之比为___________ ,与 互为等电子体的分子是
互为等电子体的分子是___________ 。
(5)步骤③的化学方程式为___________ 。
(6)步骤⑥的离子方程式为___________ 。
 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
已知:a.
 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。b.实验温度时的溶解度:

c.
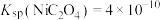
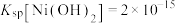
d.实验温度下相关金属离子
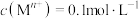 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.7 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 3.2 | 4.7 | 8.9 |
(1)加入盐酸溶液所得残渣的主要成分为
(2)根据信息判断步骤②先析出的沉淀Ⅱ为
A.
 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂(3)该工艺流程中多次重复利用的一种实验基本操作是
(4)
 的价电子轨道表示式为
的价电子轨道表示式为 中
中 键和
键和 键之比为
键之比为 互为等电子体的分子是
互为等电子体的分子是(5)步骤③的化学方程式为
(6)步骤⑥的离子方程式为
您最近一年使用:0次
4 . 8-羟基喹啉衍生物镍(II)配合物是一类具有潜在金属基抗癌活性的药物,某团队采用下列合成方法如图所示:

(1)基态Ni原子的价电子轨道表示式为___________ 。
(2)1molA配体与Ni(Ⅱ)形成的配位键有___________ mol。
(3)B中碳原子的轨道杂化方式有___________ 。
(4)甲醇的沸点(64.7℃)介于水(100℃)和二氯甲烷(39.8℃)之间,其原因是___________ 。
(5)铂镍合金在较低温度下形成一种超结构有序相,其立方晶胞结构如图所示,晶胞边长为 。该晶体的化学式为
。该晶体的化学式为___________ ,两种八面体中心的最近距离为___________ pm。


(1)基态Ni原子的价电子轨道表示式为
(2)1molA配体与Ni(Ⅱ)形成的配位键有
(3)B中碳原子的轨道杂化方式有
(4)甲醇的沸点(64.7℃)介于水(100℃)和二氯甲烷(39.8℃)之间,其原因是
(5)铂镍合金在较低温度下形成一种超结构有序相,其立方晶胞结构如图所示,晶胞边长为
 。该晶体的化学式为
。该晶体的化学式为
您最近一年使用:0次
解题方法
5 . 钙钛矿型材料具有与天然钙钛矿( )相同的晶体结构,其化学通式为
)相同的晶体结构,其化学通式为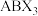 。通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。
。通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。
(1)基态Ti原子的核外价电子排布式为___________ 。
(2) 的晶胞如图a所示,与每个
的晶胞如图a所示,与每个 距离最近且相等的
距离最近且相等的 的个数为
的个数为___________ 。

(3)一种立方钙钛矿结构的金属卤化物光电材料的组成为 、
、 和有机碱离子
和有机碱离子 ,,其晶胞如图b所示。
,,其晶胞如图b所示。

①有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ ;
② 与
与 之间是否形成配位键,理由是
之间是否形成配位键,理由是___________ 。
(4)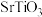 晶胞示意图如图c所示,
晶胞示意图如图c所示,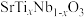 晶胞示意图如图d所示。
晶胞示意图如图d所示。

①若晶胞参数为a nm,则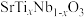 的晶体密度为
的晶体密度为_____  ,(用只含a和
,(用只含a和 的代数式表示)。
的代数式表示)。
②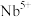 的掺杂,可以改变晶格热导率。图e显示模型计算的晶格热导率随温度变化的关系,掺杂
的掺杂,可以改变晶格热导率。图e显示模型计算的晶格热导率随温度变化的关系,掺杂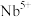 晶格热导率比未掺杂的(填“大”、“小”或者“一样”)
晶格热导率比未掺杂的(填“大”、“小”或者“一样”)___________ 。

(5)石墨烯( )负载
)负载 并用于光催化去除氨氮的催化原理如图f所示(已知
并用于光催化去除氨氮的催化原理如图f所示(已知 为中性基团),用化学用语表示阳极发生的反应
为中性基团),用化学用语表示阳极发生的反应___________ 。

 )相同的晶体结构,其化学通式为
)相同的晶体结构,其化学通式为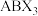 。通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。
。通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。(1)基态Ti原子的核外价电子排布式为
(2)
 的晶胞如图a所示,与每个
的晶胞如图a所示,与每个 距离最近且相等的
距离最近且相等的 的个数为
的个数为
(3)一种立方钙钛矿结构的金属卤化物光电材料的组成为
 、
、 和有机碱离子
和有机碱离子 ,,其晶胞如图b所示。
,,其晶胞如图b所示。
①有机碱
 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是②
 与
与 之间是否形成配位键,理由是
之间是否形成配位键,理由是(4)
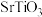 晶胞示意图如图c所示,
晶胞示意图如图c所示,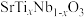 晶胞示意图如图d所示。
晶胞示意图如图d所示。
①若晶胞参数为a nm,则
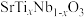 的晶体密度为
的晶体密度为 ,(用只含a和
,(用只含a和 的代数式表示)。
的代数式表示)。②
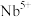 的掺杂,可以改变晶格热导率。图e显示模型计算的晶格热导率随温度变化的关系,掺杂
的掺杂,可以改变晶格热导率。图e显示模型计算的晶格热导率随温度变化的关系,掺杂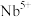 晶格热导率比未掺杂的(填“大”、“小”或者“一样”)
晶格热导率比未掺杂的(填“大”、“小”或者“一样”)
(5)石墨烯(
 )负载
)负载 并用于光催化去除氨氮的催化原理如图f所示(已知
并用于光催化去除氨氮的催化原理如图f所示(已知 为中性基团),用化学用语表示阳极发生的反应
为中性基团),用化学用语表示阳极发生的反应
您最近一年使用:0次
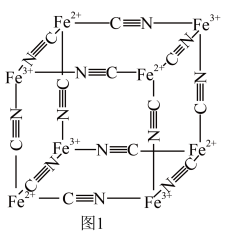
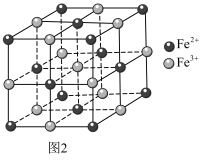
6 . 普鲁士蓝的化学式为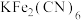 ,其结构如图1(可能位于中心的
,其结构如图1(可能位于中心的 未标出)或图2(
未标出)或图2( 、
、 未标出)所示。
未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为_______ 。
(2)已知铁的电离能数据如下:
则,铁的第四电离能( )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:_______ 。
(3)关于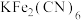 晶体下列说法不正确的是_______(填序号)。
晶体下列说法不正确的是_______(填序号)。
(4)可溶性氰化物(如KCN)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是_______ 。
(5)图2晶胞中 的个数为
的个数为_______ ,设普鲁士蓝的最简式的式量为Mr,晶体密度为 ,则相邻
,则相邻 之间的最短距离为
之间的最短距离为_______ nm。(列出计算式, 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
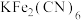 ,其结构如图1(可能位于中心的
,其结构如图1(可能位于中心的 未标出)或图2(
未标出)或图2( 、
、 未标出)所示。
未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为
(2)已知铁的电离能数据如下:
电离能/( ) ) |  |  |  |  | …… |
| Fe | 759 | 1561 | 2597 | 5290 | …… |
 )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:(3)关于
 晶体下列说法不正确的是_______(填序号)。
晶体下列说法不正确的是_______(填序号)。| A.存在的化学键有σ键、π键、配位键、离子键等 |
B.Fe、N、C的电负性由大到小的顺序: |
C.晶体中 的键能>KCN中 的键能>KCN中 的键能 的键能 |
D.晶胞中 、 、 原子均参与形成配位键,其配位数之比为6:6 原子均参与形成配位键,其配位数之比为6:6 |
(5)图2晶胞中
 的个数为
的个数为 ,则相邻
,则相邻 之间的最短距离为
之间的最短距离为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
2023-05-06更新
|
718次组卷
|
4卷引用:浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题
浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题(已下线)【2023】【高三下】【模拟考】【温州三模】【高中化学】【李鼎收集】(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题
解题方法
7 . 卡尔·巴里·夏普莱斯(KarlBarrySharpless),2001年因“不对称合成”获得诺贝尔化学奖;2022年因“点击化学”再次获得诺贝尔化学奖,成为目前在世的唯一一位2次获得诺贝尔化学奖的化学家。下图是夏普莱斯发明的一种锰手性催化剂(B)的制备过程,回答相应问题。

(1)写出基态Mn3+的价电子的轨道表示式___________ 。A中N原子的杂化方式为___________ 。
(2)单个B分子内不存在的作用力有___________ 。
a.极性键b.非极性键c.配位键d.离子键e.氢键
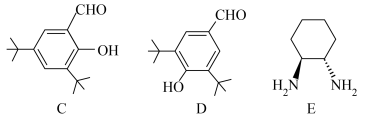
(3)A可以由C和E反应制备,C与D互为同分异构体。E分子含有___________ 个手性碳原子;比较C与D的熔点高低并说明理由___________ 。
(4)比较第三电离能:Mn___________ Fe;VSEPR模型一般不适用过渡元素,但高锰酸根适用,则高锰酸根的空间构型为___________ 。
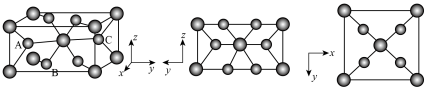
(5)Mn的某种氧化物的晶胞图和投影图如下图。已知晶胞参数为:a=b>c,α=β=γ=90°且a<1.5c.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A、B点原子的分数坐标分别为(0.8,0.2,0.5)、(0.3,0.3,0)。已知该晶体中Mn-O键长只有2种。则C点原子的分数坐标为___________ ;Mn和O之间的最短距离为___________ 。

(1)写出基态Mn3+的价电子的轨道表示式
(2)单个B分子内不存在的作用力有
a.极性键b.非极性键c.配位键d.离子键e.氢键
(3)A可以由C和E反应制备,C与D互为同分异构体。E分子含有

(4)比较第三电离能:Mn
(5)Mn的某种氧化物的晶胞图和投影图如下图。已知晶胞参数为:a=b>c,α=β=γ=90°且a<1.5c.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A、B点原子的分数坐标分别为(0.8,0.2,0.5)、(0.3,0.3,0)。已知该晶体中Mn-O键长只有2种。则C点原子的分数坐标为

您最近一年使用:0次
名校
解题方法
8 . 钴是生产电池材料、高温合金、磁性材料及催化剂的重要原料。一种以湿法炼锌净化渣(主要含有Co、Zn、Fe、Cu、Pb、ZnO、 等)为原料提取钴的工艺流程如图所示:
等)为原料提取钴的工艺流程如图所示:

已知:常温下,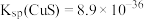 ,
,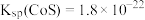 。
。
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为_______ 。
(2)“浸出渣”中一定含有的物质为_______ (填化学式)。在“浸出”过程中,使用稀硫酸,未加热和搅拌,也没有进一步研碎净化渣,但反应速率较快,原因是_______ 。
(3) 常用作沉淀剂,在“铜渣”中检测不到
常用作沉淀剂,在“铜渣”中检测不到 ,“除铜液”中
,“除铜液”中 浓度为
浓度为 ,则此时溶液的
,则此时溶液的
_______ [已知:常温下,饱和 水溶液中存在关系式:
水溶液中存在关系式: ]。
]。
(4)“氧化”过程中, 与
与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)“沉铁”过程中, 的作用是
的作用是_______ 。
(6)以1吨湿法炼锌净化渣(Co的质量分数为 )为原料提取出
)为原料提取出 。在提取过程中钴的损失率为
。在提取过程中钴的损失率为_______ (填含w、m的表达式)%。
 等)为原料提取钴的工艺流程如图所示:
等)为原料提取钴的工艺流程如图所示:
已知:常温下,
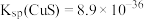 ,
,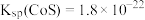 。
。回答下列问题:
(1)基态Co原子的价层电子轨道表示式为
(2)“浸出渣”中一定含有的物质为
(3)
 常用作沉淀剂,在“铜渣”中检测不到
常用作沉淀剂,在“铜渣”中检测不到 ,“除铜液”中
,“除铜液”中 浓度为
浓度为 ,则此时溶液的
,则此时溶液的
 水溶液中存在关系式:
水溶液中存在关系式: ]。
]。(4)“氧化”过程中,
 与
与 发生反应的离子方程式为
发生反应的离子方程式为(5)“沉铁”过程中,
 的作用是
的作用是(6)以1吨湿法炼锌净化渣(Co的质量分数为
 )为原料提取出
)为原料提取出 。在提取过程中钴的损失率为
。在提取过程中钴的损失率为
您最近一年使用:0次
名校
解题方法
9 . 铁、铬、铜、锌是形成许多金属材料和有机材料的重要组成元素。回答下列问题:
(1)基态铁原子的价电子排布图是___________ 。
(2)重铬酸铵[(NH4)2Cr2O7]常用作有机合成催化剂, ,的结构如图1。则:(NH4)2Cr2O7中σ键与π键数目之比为
,的结构如图1。则:(NH4)2Cr2O7中σ键与π键数目之比为___________ 。
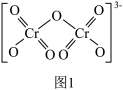
(3)研究发现,还存在如图2所示微粒。下列关于该微粒的说法中,正确的是___________。

(4)甘氨酸铜中,与铜配位的四个原子共平面,甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中,铜原子的杂化类型为___________ (选填序号)。
A.sp B.sp2 C.sp3 D.dsp2
②已知:顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水。原因可能是___________ 。
(5)许多物质的氧化物固态存在多聚体,例如:五氧化二磷实际的分子式是P4O10。实验测得磷、硫、氯三种氧化物的熔点如下表,推测固态三氧化硫实际的分子式为________ 。判断的理由是____________ 。
(6)硫化锌是一种优良的宽带隙半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。

下列说法中,不正确的是___________。
(1)基态铁原子的价电子排布图是
(2)重铬酸铵[(NH4)2Cr2O7]常用作有机合成催化剂,
 ,的结构如图1。则:(NH4)2Cr2O7中σ键与π键数目之比为
,的结构如图1。则:(NH4)2Cr2O7中σ键与π键数目之比为
(3)研究发现,还存在如图2所示微粒。下列关于该微粒的说法中,正确的是___________。

A.化学式为 |
| B.所有H-O-H键角都相同 |
| C.氢、氧原子间均以氢键结合 |
| D.氢、氧原子不可能都处于同一平面 |

①甘氨酸铜中,铜原子的杂化类型为
A.sp B.sp2 C.sp3 D.dsp2
②已知:顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水。原因可能是
(5)许多物质的氧化物固态存在多聚体,例如:五氧化二磷实际的分子式是P4O10。实验测得磷、硫、氯三种氧化物的熔点如下表,推测固态三氧化硫实际的分子式为
| P4O10 | 三氧化硫 | Cl2O7 | |
| 熔点 | 613K | 289K | 182K |

下列说法中,不正确的是___________。
| A.LixZnyS中,x:y=6:1 |
B.在ZnS体对角线的一维空间上会出现“ ”的排布规律 ”的排布规律 |
| C.在充电过程中。每转移6mol电子,生成216gLiZn(合金相) |
D.若Li2S的晶胞参数为anm,则EF间的距离为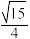 anm anm |
您最近一年使用:0次
2023-05-01更新
|
583次组卷
|
2卷引用:四川省攀枝花市2023届高三下学期第三次统一考试理综化学试题
10 . 卤族元素可以与很多元素形成多种具有不同组成、结构、性质的物质。回答下列问题:
(1)基态氟原子价电子的轨道表示式为_______ ;与溴同周期且未成对电子数目相同的元素有_______ 种。
(2)亚硝酰氯 是有机合成中的重要试剂,写出与
是有机合成中的重要试剂,写出与 互为等电子体的一种分子
互为等电子体的一种分子_______ (填化学式);苯分子中的大 键可表示为
键可表示为 ,则
,则 的大
的大 键表示为
键表示为_______ 。
(3)磷和硫均能形成多种卤化物。下列说法错误的是_______(填标号)。
A.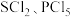 均属于非极性分子
均属于非极性分子
B.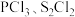 的空间构型分别为三角锥形、直线形
的空间构型分别为三角锥形、直线形
C. 分子中各原子最外层均满足8电子稳定结构
分子中各原子最外层均满足8电子稳定结构
(4)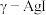 晶胞为立方结构,晶胞中
晶胞为立方结构,晶胞中 采取面心立方堆积方式(如图1);
采取面心立方堆积方式(如图1);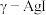 晶胞沿x、y、z轴方向的投影均如图2所示。
晶胞沿x、y、z轴方向的投影均如图2所示。

① 填充在
填充在 构成的
构成的_______ (填“正四面体”或“正八面体”)空隙,其填充率为_______ 。
②已知 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。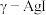 晶胞的密度为
晶胞的密度为 ,则晶胞中两个最近的
,则晶胞中两个最近的 之间的距离为
之间的距离为_______  。
。
(1)基态氟原子价电子的轨道表示式为
(2)亚硝酰氯
 是有机合成中的重要试剂,写出与
是有机合成中的重要试剂,写出与 互为等电子体的一种分子
互为等电子体的一种分子 键可表示为
键可表示为 ,则
,则 的大
的大 键表示为
键表示为(3)磷和硫均能形成多种卤化物。下列说法错误的是_______(填标号)。
A.
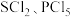 均属于非极性分子
均属于非极性分子B.
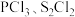 的空间构型分别为三角锥形、直线形
的空间构型分别为三角锥形、直线形C.
 分子中各原子最外层均满足8电子稳定结构
分子中各原子最外层均满足8电子稳定结构(4)
 晶胞为立方结构,晶胞中
晶胞为立方结构,晶胞中 采取面心立方堆积方式(如图1);
采取面心立方堆积方式(如图1); 晶胞沿x、y、z轴方向的投影均如图2所示。
晶胞沿x、y、z轴方向的投影均如图2所示。
①
 填充在
填充在 构成的
构成的②已知
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞的密度为
晶胞的密度为 ,则晶胞中两个最近的
,则晶胞中两个最近的 之间的距离为
之间的距离为 。
。
您最近一年使用:0次



