解题方法
1 . 第IIIA元素硼及其化合物在能源、材料、医药、环保等领域具有重要应用。回答下列问题:
(1)基态B原子价层电子的轨道表示式:___________ 。
(2)已知: 有空轨道,可以与
有空轨道,可以与 分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
①下列卤化物不易发生水解的是___________ 。
A. B.
B. C.
C. D.
D.
②写出 水解的化学方程式
水解的化学方程式___________ 。
③写出 与NaOH溶液反应的离子方程式
与NaOH溶液反应的离子方程式___________ 。
(3)硼砂的阴离子的结构如图1,1mol该离子中有___________ 个硼氧四面体,含有配位键数目为___________ ,其中硼原子的杂化轨道类型为___________ 。

(4)硼化镁在39K温度下具有超导性,硼原子和镁原子分层排布,一层硼一层镁相间,部分原子沿垂直片层方向投影如图2,则硼化镁的化学式为___________ 。

(1)基态B原子价层电子的轨道表示式:
(2)已知:
 有空轨道,可以与
有空轨道,可以与 分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。①下列卤化物不易发生水解的是
A.
 B.
B. C.
C. D.
D.
②写出
 水解的化学方程式
水解的化学方程式③写出
 与NaOH溶液反应的离子方程式
与NaOH溶液反应的离子方程式(3)硼砂的阴离子的结构如图1,1mol该离子中有

(4)硼化镁在39K温度下具有超导性,硼原子和镁原子分层排布,一层硼一层镁相间,部分原子沿垂直片层方向投影如图2,则硼化镁的化学式为

您最近一年使用:0次
解题方法
2 . I.回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是_____________ 。
(2)基态As原子的价电子排布图为__________ ,基态Ga原子核外有____________ 个未成对电子。
(3)科学家合成了一种含硼阴离子[ ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为____ ,该结构中共有____________ 种不同化学环境的氧原子。

(4)四方晶系的CuFeS2晶胞结构如图所示:

①CuFeS2中各元素电负性数值从小到大的顺序为_______ ,晶胞中S原子的杂化方式为_________ 。
②晶胞中Cu和Fe的投影位置如图所示,设阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3。

(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)基态As原子的价电子排布图为
(3)科学家合成了一种含硼阴离子[
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
(4)四方晶系的CuFeS2晶胞结构如图所示:

①CuFeS2中各元素电负性数值从小到大的顺序为
②晶胞中Cu和Fe的投影位置如图所示,设阿伏加德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
3 . I.2022年4月,大型运输机运−20向塞尔维亚远程运送“常规军事物资”,展示了大国重器“鲲鹏”的突出性能,为世人瞩目。
(1)运−20的外壳大量使用了AM系列Mg−Al−Mn,铝的价电子排布图为___________ ,第一电离能铝___________ (填“大于”、“等于”或“小于”)镁,镁原子核外有___________ 种不同运动状态的电子。
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为___________ ,其个数比为___________ 。

Ⅱ.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___________ 。
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___________ ,其中一个钨原子周围距离最近且相等的碳原子有___________ 个。

(5)已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为M g∙mol−1。该晶体密度为___________ g∙cm−3。
(1)运−20的外壳大量使用了AM系列Mg−Al−Mn,铝的价电子排布图为
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为

Ⅱ.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为

(5)已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为M g∙mol−1。该晶体密度为
您最近一年使用:0次
4 . 锌是动物必需的微量元素之一,参与机体的各种代谢活动。
(1)Zn位于元素周期表的___________ 区,基态Zn原子的价电子排布图为___________ 。
(2)第二电离能:Cu___________ Zn(填“>”、“<”或“=”),判断依据是___________ 。
(3)含有多个配位原子的配体与同一个中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物,一种Zn2+配合物的结构如图1所示(-OTs为含氧、硫的有机基团):

①1mol该配合物中通过螯合作用形成的配位键有___________ mol,该螯合物中N原子的杂化类型为___________ 。
②该配合物所涉及非金属元素电负性最小的是___________ (填元素符号)。
(4)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图2所示,晶体中正负离子的配位数之比为___________ 。

(5)已知每个Zn2+与其周围最近的S2-之间的距离都相等,以晶胞参数为单位长度建立坐标系,若A点坐标为(0,0,0),B点坐标为( ,
, ,
, ),C点坐标为(0,0,u),则D点坐标为
),C点坐标为(0,0,u),则D点坐标为___________ 。
(1)Zn位于元素周期表的
(2)第二电离能:Cu
(3)含有多个配位原子的配体与同一个中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物,一种Zn2+配合物的结构如图1所示(-OTs为含氧、硫的有机基团):

①1mol该配合物中通过螯合作用形成的配位键有
②该配合物所涉及非金属元素电负性最小的是
(4)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图2所示,晶体中正负离子的配位数之比为

(5)已知每个Zn2+与其周围最近的S2-之间的距离都相等,以晶胞参数为单位长度建立坐标系,若A点坐标为(0,0,0),B点坐标为(
 ,
, ,
, ),C点坐标为(0,0,u),则D点坐标为
),C点坐标为(0,0,u),则D点坐标为
您最近一年使用:0次
2023-04-16更新
|
535次组卷
|
4卷引用:广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题
广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)四川省宜宾市第四中学校2023-2024学年高三上学期开学理综化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
5 . 碳的多种同素异形体及一系列化合物广泛应用于科研、医疗、工农业生产等领域。回答下列问题:
(1)写出基态C原子核外电子排布的轨道表示式________________________ 。
(2)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多, C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是 (填编号)。
(3)TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为________ , 其空间构型为_______________ 。
(4)甲乙酮肟( )中同周期三种元素电负性由大到小的顺序为
)中同周期三种元素电负性由大到小的顺序为___________________ ,氮原子的杂化方式为________________ ,C=N与C-C键夹角_______________ C=N与N-O键夹角(填“<”“>”或“=”)。
(5)CO2分子中并不存在简单的“碳氧双键”,除了正常的σ键,还有两个方向互相垂直的大π键(每个O原子上还有一对孤对电子),则每个大π键中有______ 个电子。
(6)从化学键的角度解释石墨的熔点高于金刚石的原因_________________ 。
(7)利用皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管可以合成T-碳。T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示[其中图(a)、(b) 为T-碳的晶胞和晶胞俯视图,图(c)为金刚石晶胞]。
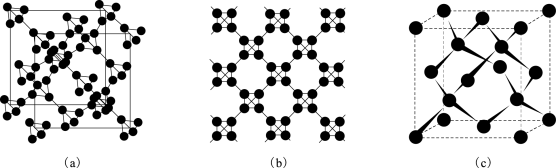
一个T-碳晶胞中含有____ 个碳原子。 T-碳的密度非常小,是金刚石的一半,则T-碳晶胞的棱长和金刚石晶胞的棱长之比为________________ 。
(1)写出基态C原子核外电子排布的轨道表示式
(2)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多, C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是 (填编号)。
| A.CH4 | B.CH2=CH2 | C.CH ≡ CH | D.苯 |
(4)甲乙酮肟(
 )中同周期三种元素电负性由大到小的顺序为
)中同周期三种元素电负性由大到小的顺序为(5)CO2分子中并不存在简单的“碳氧双键”,除了正常的σ键,还有两个方向互相垂直的大π键(每个O原子上还有一对孤对电子),则每个大π键中有
(6)从化学键的角度解释石墨的熔点高于金刚石的原因
(7)利用皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管可以合成T-碳。T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示[其中图(a)、(b) 为T-碳的晶胞和晶胞俯视图,图(c)为金刚石晶胞]。

一个T-碳晶胞中含有
您最近一年使用:0次
解题方法
6 . 各种材料的应用使人们的生活变得丰富多彩。
I.某有机发光材料的结构如图1所示。
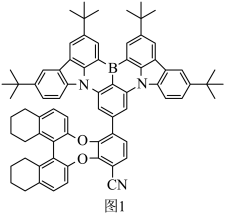
(1)基态N原子的价层电子排布图为_______ ,其中能量最高的电子所占据的原子轨道有_______ 个伸展方向。
(2)B原子与其直接相连的3个碳原子构成的空间结构为_______ 形。
(3)C原子的杂化类型为_______ 。
(4)该物质中第二周期元素的第一电离能由大到小的顺序为_______ (填元素符号)。
II.我国某科研团队首次成功合成单金属内面体偶氮富勒烯(La@C81N)。单晶X射线衍射实验研究表明La@C81 N具有对称性的82原子笼,结构如图2所示。
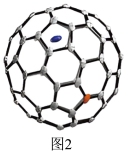
(5)基态La(镧)原子的价层电子排布式为5d1 6s2,与Sc(钪)位于同族,则La位于元素周期表的_______ 区。
(6)1640年Descartes首先证明了“欧拉定理”,即顶点数+面数一棱数=2。1个C81N82原子笼中含_______ 个正六边形、_______ 个正五边形。
III.硒氧化铋是很好的二维半导体材料,其晶胞结构如图3所示。
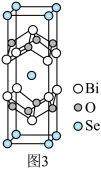
(7)①晶胞中与O最近且等距离的Bi原子数为_______ 。
②已知晶胞参数分别为anm、bnm、cnm,阿伏加德罗常数为NA,则该晶胞的密度为_______ g·cm-3。
I.某有机发光材料的结构如图1所示。

(1)基态N原子的价层电子排布图为
(2)B原子与其直接相连的3个碳原子构成的空间结构为
(3)C原子的杂化类型为
(4)该物质中第二周期元素的第一电离能由大到小的顺序为
II.我国某科研团队首次成功合成单金属内面体偶氮富勒烯(La@C81N)。单晶X射线衍射实验研究表明La@C81 N具有对称性的82原子笼,结构如图2所示。

(5)基态La(镧)原子的价层电子排布式为5d1 6s2,与Sc(钪)位于同族,则La位于元素周期表的
(6)1640年Descartes首先证明了“欧拉定理”,即顶点数+面数一棱数=2。1个C81N82原子笼中含
III.硒氧化铋是很好的二维半导体材料,其晶胞结构如图3所示。

(7)①晶胞中与O最近且等距离的Bi原子数为
②已知晶胞参数分别为anm、bnm、cnm,阿伏加德罗常数为NA,则该晶胞的密度为
您最近一年使用:0次
7 . 介孔 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为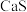 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
(1)基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2)“生物浸出”时, 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为___________ 。此时铁盐___________ (填“作氧化剂”、“作还原剂”或“既不是氧化剂,也不是还原剂”)。
(3)将“浸渣”溶于 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出___________ (填化学式)。
(4)实验室“萃取”时,用到的主要仪器是___________ ,若萃取剂为苯,“萃取”后得到的“水相”位于___________ (填“上层”或“下层”)。
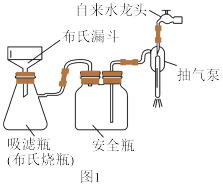
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是___________ 。
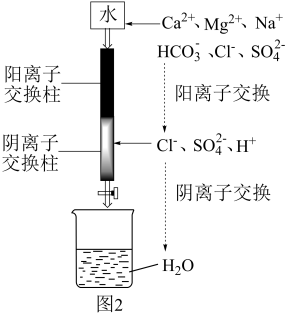
(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为___________ 。
(7)某工厂用10吨该矿石合成介孔 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,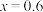 ,则最终可以得到
,则最终可以得到
___________ 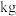 。
。
 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为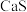 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)“生物浸出”时,
 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为(3)将“浸渣”溶于
 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出(4)实验室“萃取”时,用到的主要仪器是
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是

(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为

(7)某工厂用10吨该矿石合成介孔
 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,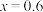 ,则最终可以得到
,则最终可以得到
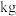 。
。
您最近一年使用:0次
名校
解题方法
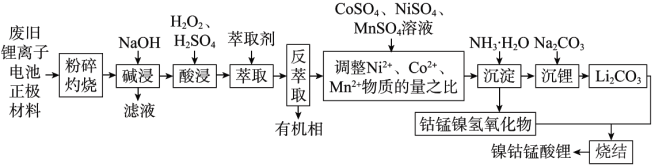
8 . 镍钴锰酸锂材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等优点,这类材料可以同时有效克服钴酸锂材料成本过高、磷酸铁锂容量低等问题,工业上可由废旧的钴酸锂、磷酸铁锂、镍酸锂、锰酸锂电池正极材料(还含有铝箔、炭黑、有机黏合剂等),经过一系列工艺流程制备镍钴锰酸锂材料,该材料可用于三元锂电池的制备,实现电池的回收再利用,工艺流程如下图所示:
已知:①粉碎灼烧后主要成分是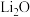 、
、 、
、 、MnO、Fe2O3、
、MnO、Fe2O3、 ;
;
②萃取剂对 选择性很高,且生成的物质很稳定,有机相中的
选择性很高,且生成的物质很稳定,有机相中的 很难被反萃取
很难被反萃取
请回答下列问题:
(1)正极材料在“灼烧”前先粉碎的目的是___________ 。
(2)“碱浸”的目的是___________ ,涉及的化学方程式是___________ 。
(3)“酸浸”时加入 的作用是
的作用是___________ 。
(4)上述工艺流程中采用萃取法净化除去了 ,若采用沉淀法除去铁元素,结合下表,最佳的pH范围是
,若采用沉淀法除去铁元素,结合下表,最佳的pH范围是___________ 。
(5)镍钴锰酸锂材料中根据镍钴锰的比例不同,可有不同的结构,其中一种底面为正六边形结构的晶胞如图所示。
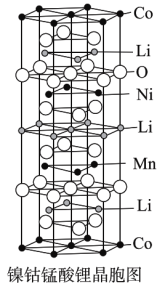
①该物质的化学式为___________ ,写出基态Mn原子价层电子的轨道表示式___________ 。
②已知晶胞底面边长是anm,高是bnm,一个晶胞的质量为Mg,计算该晶胞的密度
___________  (用计算式表示)。
(用计算式表示)。

已知:①粉碎灼烧后主要成分是
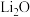 、
、 、
、 、MnO、Fe2O3、
、MnO、Fe2O3、 ;
;②萃取剂对
 选择性很高,且生成的物质很稳定,有机相中的
选择性很高,且生成的物质很稳定,有机相中的 很难被反萃取
很难被反萃取请回答下列问题:
(1)正极材料在“灼烧”前先粉碎的目的是
(2)“碱浸”的目的是
(3)“酸浸”时加入
 的作用是
的作用是(4)上述工艺流程中采用萃取法净化除去了
 ,若采用沉淀法除去铁元素,结合下表,最佳的pH范围是
,若采用沉淀法除去铁元素,结合下表,最佳的pH范围是 |  |  |  |  |  | |
| 开始沉淀时pH | 1.5 | 3.4 | 6.3 | 6.6 | 6.7 | 7.8 |
| 完全沉淀时pH | 3.5 | 4.7 | 8.3 | 9.2 | 9.5 | 10.4 |

①该物质的化学式为
②已知晶胞底面边长是anm,高是bnm,一个晶胞的质量为Mg,计算该晶胞的密度

 (用计算式表示)。
(用计算式表示)。
您最近一年使用:0次
2023-03-18更新
|
1388次组卷
|
5卷引用:广东省湛江市2023届高三一模考试化学试题
广东省湛江市2023届高三一模考试化学试题(已下线)广东省湛江市2023届高三下学期普通高考测试(一)化学试题(已下线)专题18 工艺流程题辽宁省沈阳市东北育才学校(高中部)2022-2023学年高二下学期4月月考化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(工业流程题)
名校
9 . 从砷化镓废料(主要成分为GaAs,含 、
、 和
和 等杂质)中回收镓和砷的工艺流程如下:
等杂质)中回收镓和砷的工艺流程如下:
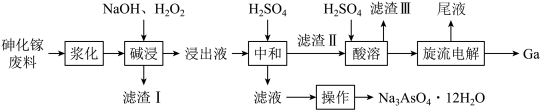
已知: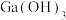 是两性氢氧化物。
是两性氢氧化物。
25℃时,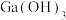 的溶度积
的溶度积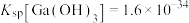 ,
,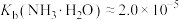 。回答下列问题:
。回答下列问题:
(1)“滤渣Ⅱ”的成分为_______ (填化学式)。
(2)基态砷原子的价电子排布图为_______ ;砷化镓(GaAs)和氮化硼(BN)晶体都具有空间网状结构,硬度大,则砷化镓的熔点_______ 氮化硼的熔点(填“高于”“低于”或“等于”)。
(3)砷化镓(GaAs)在“碱浸”时,砷化镓转化为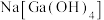 和
和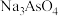 进入溶液,该反应的化学方程式为
进入溶液,该反应的化学方程式为_______ 。
(4)“碱浸”的温度控制在70℃左右,温度不能过高或过低的原因是_____ 。
(5)向“中和”后得到的滤液中加入足量NaOH溶液,使pH大于12,经_______ 、降温结晶、过滤、洗涤、低温干燥后得到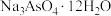 。
。
(6)为探究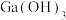 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应 的平衡常数K=
的平衡常数K=_______ 。(已知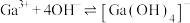
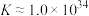 )
)
 、
、 和
和 等杂质)中回收镓和砷的工艺流程如下:
等杂质)中回收镓和砷的工艺流程如下:
已知:
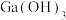 是两性氢氧化物。
是两性氢氧化物。25℃时,
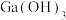 的溶度积
的溶度积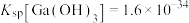 ,
,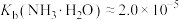 。回答下列问题:
。回答下列问题:(1)“滤渣Ⅱ”的成分为
(2)基态砷原子的价电子排布图为
(3)砷化镓(GaAs)在“碱浸”时,砷化镓转化为
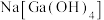 和
和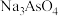 进入溶液,该反应的化学方程式为
进入溶液,该反应的化学方程式为(4)“碱浸”的温度控制在70℃左右,温度不能过高或过低的原因是
(5)向“中和”后得到的滤液中加入足量NaOH溶液,使pH大于12,经
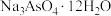 。
。(6)为探究
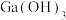 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应 的平衡常数K=
的平衡常数K=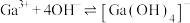
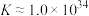 )
)
您最近一年使用:0次
2023-03-17更新
|
336次组卷
|
2卷引用:湖南省平江县第一中学2023届高三下学期适应性考试(二)化学试题
解题方法
10 . 电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 、
、 、
、 元素的化合物)和黄铁矿
元素的化合物)和黄铁矿 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
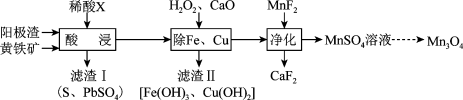
已知: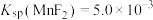 、
、 ,回答下列问题:
,回答下列问题:
(1)锰原子价层电子的轨道表示式为_______ ,它处于周期表的_______ 区, 中
中 的化合价为
的化合价为_______ 。
(2)“酸浸”时,所用的稀酸X是_______ 。
(3)“酸浸”过程中, 、
、 的质量浓度、
的质量浓度、 浸出率与时间的关系如图1所示。
浸出率与时间的关系如图1所示。
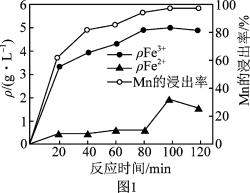
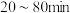 内,浸出
内,浸出 元素的主要离子方程式为
元素的主要离子方程式为_______ 。
(4)若“净化”过程中 的浓度为
的浓度为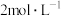 ,则此时
,则此时 的浓度为
的浓度为_______  。
。
(5) 是一种两性氧化物,用软锰矿(主要成分为
是一种两性氧化物,用软锰矿(主要成分为 ,含少量铁的氧化物)和
,含少量铁的氧化物)和 可制备高纯
可制备高纯 。保持
。保持 投料量不变,随
投料量不变,随 与
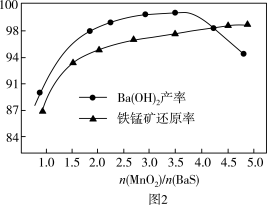
与 投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当
投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当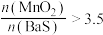 时,
时, 产率减小的原因是
产率减小的原因是_______ 。
(6)碳酸锰在空气中加热可以生成相应的氧化物,称取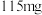 碳酸锰(摩尔质量
碳酸锰(摩尔质量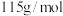 )加热,固体物质的质量随温度的变化如图3所示。
)加热,固体物质的质量随温度的变化如图3所示。
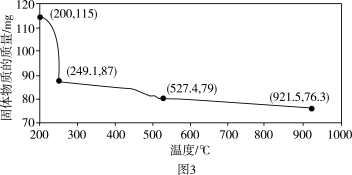
527.4℃时, 生成相应固体物质的化学方程式为
生成相应固体物质的化学方程式为_______ 。
 ,杂质为
,杂质为 、
、 、
、 元素的化合物)和黄铁矿
元素的化合物)和黄铁矿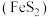 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知:
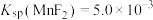 、
、 ,回答下列问题:
,回答下列问题:(1)锰原子价层电子的轨道表示式为
 中
中 的化合价为
的化合价为(2)“酸浸”时,所用的稀酸X是
(3)“酸浸”过程中,
 、
、 的质量浓度、
的质量浓度、 浸出率与时间的关系如图1所示。
浸出率与时间的关系如图1所示。
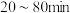 内,浸出
内,浸出 元素的主要离子方程式为
元素的主要离子方程式为(4)若“净化”过程中
 的浓度为
的浓度为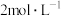 ,则此时
,则此时 的浓度为
的浓度为 。
。(5)
 是一种两性氧化物,用软锰矿(主要成分为
是一种两性氧化物,用软锰矿(主要成分为 ,含少量铁的氧化物)和
,含少量铁的氧化物)和 可制备高纯
可制备高纯 。保持
。保持 投料量不变,随
投料量不变,随 与
与 投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当
投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当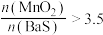 时,
时, 产率减小的原因是
产率减小的原因是
(6)碳酸锰在空气中加热可以生成相应的氧化物,称取
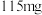 碳酸锰(摩尔质量
碳酸锰(摩尔质量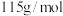 )加热,固体物质的质量随温度的变化如图3所示。
)加热,固体物质的质量随温度的变化如图3所示。
527.4℃时,
 生成相应固体物质的化学方程式为
生成相应固体物质的化学方程式为
您最近一年使用:0次
2023-03-04更新
|
971次组卷
|
4卷引用:广东省汕头市2023届高三一模化学试题
广东省汕头市2023届高三一模化学试题广东省汕头市2023届高三下学期第一次模拟考试化学试题(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)专题18 工艺流程题



