我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A. B.
B. 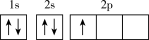
C.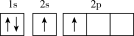 D.
D. 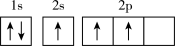
(2)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。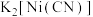 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(3)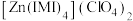 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为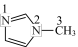 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。
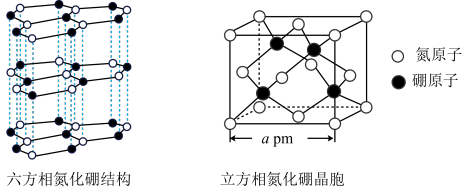
①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(5)红银矿NiAs晶体结构如图所示:
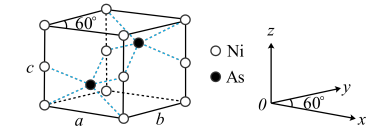
①两个As原子的原子分数坐标依次为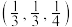 和
和_______ 。
②已知 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体,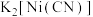 是红黄色单斜晶体。
是红黄色单斜晶体。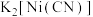 的熔点高于
的熔点高于 的原因是
的原因是(3)
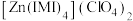 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为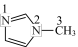 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为
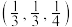 和
和②已知
 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
更新时间:2024-03-17 18:20:21
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】FeSe、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________ ,基态Se原子的电子占据最高能级的电子云轮廓图为________ 形。
(2)向FeSe中嵌入吡啶(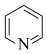 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________ ;该分子内存在________ (填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________ 。
②液氨是氨气液化的产物,氨气易液化的原因是________ 。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________ 。
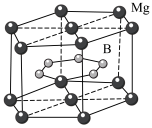
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________ 个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)向FeSe中嵌入吡啶(
 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为
②液氨是氨气液化的产物,氨气易液化的原因是
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮族元素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
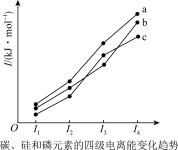
(1)As原子的价电子的轨道表示式为_______ ,同周期中与其具有相同未成对电子数的元素还有_______ 种。如图表示碳、硅和磷元素的四级电离变化趋势,其中表示碳元素的曲线是_______ (填标号)。
(2)含有氨基物质的碱性随着N原子电子云密度的增大而增强,则NH3、CH3NH2、NH2OH的碱性由强到弱的顺序为_______ 。
(3)配合物甘氨酸亚铁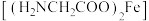 的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为
的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为_______ ,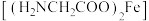 中σ键与π键的个数比为
中σ键与π键的个数比为_______ 。
(4)气态 PCl5空间构型为三角双锥,结构如图1,其中心原子的杂化类型为_______ (填符号),
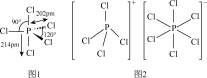
a. b.
b. c.
c.
PCl5的二溴代物PCl3Br2的结构有_______ 种;固态PCl5中含有正四面体形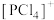 和正八面体形的
和正八面体形的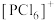 如图2,而固态PBr5却含有
如图2,而固态PBr5却含有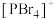 和Br-,不能形成
和Br-,不能形成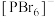 的原因是
的原因是_______ 。
(1)As原子的价电子的轨道表示式为

(2)含有氨基物质的碱性随着N原子电子云密度的增大而增强,则NH3、CH3NH2、NH2OH的碱性由强到弱的顺序为
(3)配合物甘氨酸亚铁
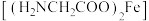 的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为
的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为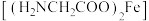 中σ键与π键的个数比为
中σ键与π键的个数比为(4)气态 PCl5空间构型为三角双锥,结构如图1,其中心原子的杂化类型为

a.
 b.
b. c.
c.
PCl5的二溴代物PCl3Br2的结构有
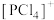 和正八面体形的
和正八面体形的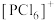 如图2,而固态PBr5却含有
如图2,而固态PBr5却含有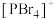 和Br-,不能形成
和Br-,不能形成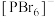 的原因是
的原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】有A、B、C、D、E、F、G七种元素,它们的原子序数依次增大。其中A、B、C、D、E 、F为短周期主族元素, G为第四周期元素。请回答问题。
(1)D是___________ ,E是___________ (填元素符号)。
(2)B基态原子中能量最高的电子,原子轨道呈__________ 形。
(3)比较键长:A — B__________ A — C (填“>”、“=”或“<”)
(4)G的原子结构示意图为:____________ ,G3+ 离子电子排布式为_________________ 。
(5)某同学根据上述信息,推断D基态原子的核外电子排布图为,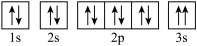 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了____________________ 。
(6)金属铜和B的最高价氧化物的水化物的稀溶液可以反应,反应的离子方程式为:_________________ 。
| A是宇宙中最丰富的元素,其电子数和电子层数相等 |
| B原子的核外p电子数比s电子数少1 |
| C基态原子L层无空轨道,且成对电子与不成对电子占据的轨道数相等 |
| D原子的第一至第四电离能分别是: I1=730 kJ/mol I2 = 1455 kJ/mol I3 = 8633 kJ/mol I4= 11580 kJ/mol |
| E常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
| F电负性比E大,其单质的水溶液具有漂白性 |
| G在周期表的第八列,是地壳中含量第二位的金属 |
(1)D是
(2)B基态原子中能量最高的电子,原子轨道呈
(3)比较键长:A — B
(4)G的原子结构示意图为:
(5)某同学根据上述信息,推断D基态原子的核外电子排布图为,
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(6)金属铜和B的最高价氧化物的水化物的稀溶液可以反应,反应的离子方程式为:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】Cu2O广泛应用于太阳能电池。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为_______ 。
(2)Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的存在的化学键_______。
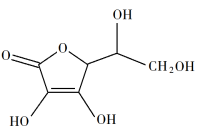
(3)抗坏血酸的分子结构如图所示,其中碳原子的杂化轨道类型是_______ 。_______ 。_______ g/cm3(只列出计算表达式)
(1)Cu2+基态核外电子排布式为
(2)Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的存在的化学键_______。
| A.离子键 | B.极性共价键 | C.配位键 | D.氢键 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示:
(1)溴化钠晶体比氯化钠晶体晶格能________ (填“大”或“小”),主要原因是________________________________________________________________________ 。
(2)氧化镁晶体比氯化钠晶体晶格能大,主要原因是________________________________________________________________________ 。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是________ 。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是________________________________________________________________________ 。
| NaBr | NaCl | MgO | |
| 离子的核间距/pm | 290 | 276 | 205 |
| 晶格能/kJ·mol-1 | 787 | 3890 |
(2)氧化镁晶体比氯化钠晶体晶格能大,主要原因是
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】元素周期表中7种元素分别用X、Y、Z、M、Q、R、W表示。X原子是最外层电子排布为nsn的非金属元素,Y原子核外的L层电子数是K层的2倍,Z是地壳内含量最高的元素,M原子的3p能级有一个空轨道,q元素为短周期元素中金属性最强的元素,请回答下列问题:
(1)Y、Z、M、Q四种元素的第一电离能由大到小的顺序为_______ (用元素符号和“>”表示)。
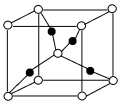
(2)R、W形成的合金其晶胞结构如图1所示:
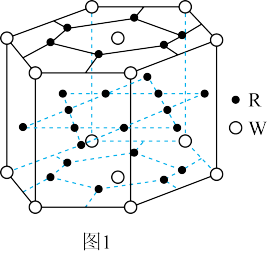
则它的化学式为_______ 。
(3)Z和Q形成的化合物可能含有的化学键有_______ ,Y、Z和Q三种元素共同形成的常见6原子化合物中,阴离子的中心原子杂化类型为 _______ ,立体空间构型为 _______ 。
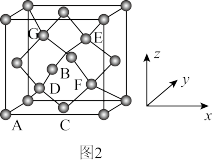
(4)如图2为M单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则E原子的坐标参数为
,0)。则E原子的坐标参数为 _______ ;已知M单晶的晶胞参数apm,其密度为 _______  。
。
(1)Y、Z、M、Q四种元素的第一电离能由大到小的顺序为
(2)R、W形成的合金其晶胞结构如图1所示:

则它的化学式为
(3)Z和Q形成的化合物可能含有的化学键有
(4)如图2为M单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则E原子的坐标参数为
,0)。则E原子的坐标参数为  。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】过渡元素锰能形成很多重要的化合物。三醋酸锰[(CH3CO0)3Mn)]是一种很好的有机反应氧化剂,可由硝酸锰晶体和乙酸酐反应制得:4Mn(NO3)2·6H2O+26(CH3CO)2O = 4(CH3COO)3Mn+8HNO2+3O2↑+ 40CH3COOH,请回答下列问题:
(1)CH3COOH中所含元素的电负性由大到小的顺序为___________ (用元素符号表示)。
(2) 的空间结构
的空间结构 ___________
(3)三醋酸锰[(CH3COO)3Mn)]中阳离子的价层电子的轨道表示式为___________ ,该价层排布式中电子的自旋状态 ___________ (填“相同”或“相反”)。
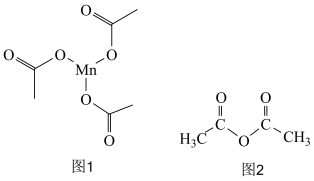
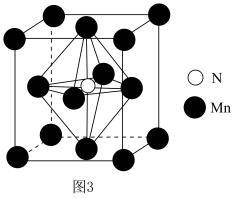
(4)三醋酸锰是一种配合物,其结构如图1所示,其中配位键数为___________ 。乙酸酐[(CH3CO)2O]可由CH3COOH在一定条件下脱水形成,其结构如图2所示,已知羧酸是一大类含羧基(-COOH)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释CH3COOH的酸性强于CH3CH2COOH的原因 ___________
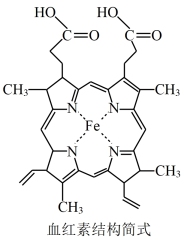
(5)氮化锰的立方晶胞结构如图3所示,该晶胞的晶胞参数为anm,NA为阿伏加德罗常数的值。
①氮化锰的化学式为___________ 。
②该晶体的密度为___________ (用a、NA的代数式表示)。
(1)CH3COOH中所含元素的电负性由大到小的顺序为
(2)
 的空间结构
的空间结构 (3)三醋酸锰[(CH3COO)3Mn)]中阳离子的价层电子的轨道表示式为
(4)三醋酸锰是一种配合物,其结构如图1所示,其中配位键数为

(5)氮化锰的立方晶胞结构如图3所示,该晶胞的晶胞参数为anm,NA为阿伏加德罗常数的值。

①氮化锰的化学式为
②该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】血红素是由卟啉与 形成的配合物。血红素不溶于水,溶于丙酮
形成的配合物。血红素不溶于水,溶于丙酮 和碱性水溶液。
和碱性水溶液。
(1)请写出Fe在元素周期表中的位置___________ ,基态 的核外电子排布式为
的核外电子排布式为___________ 。
(2)血红素分子中N原子的杂化轨道类型有___________ ,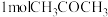 含有
含有 键的数目为
键的数目为___________ 。
(3)KSCN或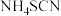 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 的空间构型为
的空间构型为___________ (用文字描述),写出一种与 互为等电子体的分子
互为等电子体的分子_______ (写化学式)。
(4)丙酮和乙醇的有关数据如下:
丙酮和乙醇的晶体类型均为___________ ,它们沸点差异的原因是___________ 。
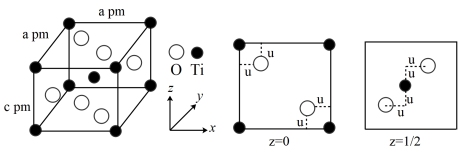
(5)在自然界中 有三种晶型,其中最重要的是金红石型,晶胞结构和投影图如下,晶胞棱边夹角均为
有三种晶型,其中最重要的是金红石型,晶胞结构和投影图如下,晶胞棱边夹角均为 ,晶胞参数为apm、apm、cpm,设阿伏加德罗常数的值为NA,则
,晶胞参数为apm、apm、cpm,设阿伏加德罗常数的值为NA,则 离子的配位数是
离子的配位数是___________ , 的密度为
的密度为___________  (列出计算式)。
(列出计算式)。
 形成的配合物。血红素不溶于水,溶于丙酮
形成的配合物。血红素不溶于水,溶于丙酮 和碱性水溶液。
和碱性水溶液。
(1)请写出Fe在元素周期表中的位置
 的核外电子排布式为
的核外电子排布式为(2)血红素分子中N原子的杂化轨道类型有
 含有
含有 键的数目为
键的数目为(3)KSCN或
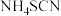 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(4)丙酮和乙醇的有关数据如下:
| 化合物 | 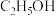 (乙醇) (乙醇) |  (丙酮) (丙酮) |
| 沸点/℃ | 78 | 56.5 |
(5)在自然界中
 有三种晶型,其中最重要的是金红石型,晶胞结构和投影图如下,晶胞棱边夹角均为
有三种晶型,其中最重要的是金红石型,晶胞结构和投影图如下,晶胞棱边夹角均为 ,晶胞参数为apm、apm、cpm,设阿伏加德罗常数的值为NA,则
,晶胞参数为apm、apm、cpm,设阿伏加德罗常数的值为NA,则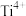 离子的配位数是
离子的配位数是 的密度为
的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】据国际权威学术期刊《自然》报道,我国科学家选择碲化锆( )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应。
)为材料验证了三维量子霍尔效应。
(1)Zr与Ti同族且在Ti的下一周期。Zr位于元素周期表的第_______ 周期,第_______ 族。
(2)Te是第五周期的氧族元素,推测它可能具有的性质是_______ (填序号)。
a.室温下单质为固体
b.单质具有半导体性能
c.单质在常温下可与氢气化合
d.最高价氧化物的水化物的酸性比硫酸强
(3) 与
与 可形成离子
可形成离子 。
。
① 中存在
中存在_______ (填序号)。
a.氢键 b.σ键 c.π键 d.配位键
②已知该离子中2个 被2个
被2个 替代只得到一种结构,则该离子的空间结构为
替代只得到一种结构,则该离子的空间结构为_______ 。
(4)某种掺杂CaO的 晶胞如图所示,Ca位于晶胞的面心。
晶胞如图所示,Ca位于晶胞的面心。_______ 个。
②已知该晶胞为立方晶胞,晶胞棱长为apm,设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ 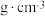 。
。
(5)若锆石中含Zr元素的质量分数是36.4%,在制备 的过程中会损失10%的锆元素,则1kg锆石理论上能够制得
的过程中会损失10%的锆元素,则1kg锆石理论上能够制得 的质量是
的质量是_______ g。
 )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应。
)为材料验证了三维量子霍尔效应。(1)Zr与Ti同族且在Ti的下一周期。Zr位于元素周期表的第
(2)Te是第五周期的氧族元素,推测它可能具有的性质是
a.室温下单质为固体
b.单质具有半导体性能
c.单质在常温下可与氢气化合
d.最高价氧化物的水化物的酸性比硫酸强
(3)
 与
与 可形成离子
可形成离子 。
。①
 中存在
中存在a.氢键 b.σ键 c.π键 d.配位键
②已知该离子中2个
 被2个
被2个 替代只得到一种结构,则该离子的空间结构为
替代只得到一种结构,则该离子的空间结构为(4)某种掺杂CaO的
 晶胞如图所示,Ca位于晶胞的面心。
晶胞如图所示,Ca位于晶胞的面心。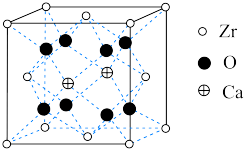
②已知该晶胞为立方晶胞,晶胞棱长为apm,设阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为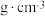 。
。(5)若锆石中含Zr元素的质量分数是36.4%,在制备
 的过程中会损失10%的锆元素,则1kg锆石理论上能够制得
的过程中会损失10%的锆元素,则1kg锆石理论上能够制得 的质量是
的质量是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铜元素的化合价有+1、+2.铜元素常见的+1价化合物有氧化亚铜和氯化亚铜,回答下列问题:
I.氧化亚铜是一种砖红色物质,用途非常广泛。某化工厂以某铜矿(主要含CuS、FeO)为原料制备Cu2O的一种工艺流程如下图:

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表。
(1)Cu的第二电离能远大于第一电离能的原因是___________ 。
(2)滤渣的主要成分是MnCO3,写出生成它的离子方程式:___________ 。
(3)“调pH”的范围是___________ 。
(4)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,还原过程中氧化剂与还原剂的物质的量之比为___________ 。
Ⅱ.氯化亚铜是一种重要的工业原料和应用广泛的催化剂。
(5)CuCl的晶胞中,C1-的位置如图所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为___________ ;若NA为阿伏加德罗常数的值,该晶体的密度为pg·cm-3,则该晶胞中Cu+之间的最短距离为___________ nm(用含p、NA的代数式表示)。
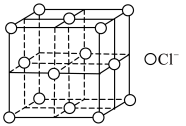
I.氧化亚铜是一种砖红色物质,用途非常广泛。某化工厂以某铜矿(主要含CuS、FeO)为原料制备Cu2O的一种工艺流程如下图:

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表。
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 4.8 | 1.9 | 7.5 | 8.8 |
| 沉淀完全的pH | 6.4 | 3.2 | 9.7 | 10.4 |
(1)Cu的第二电离能远大于第一电离能的原因是
(2)滤渣的主要成分是MnCO3,写出生成它的离子方程式:
(3)“调pH”的范围是
(4)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,还原过程中氧化剂与还原剂的物质的量之比为
Ⅱ.氯化亚铜是一种重要的工业原料和应用广泛的催化剂。
(5)CuCl的晶胞中,C1-的位置如图所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】硼及其化合物的研究在无机化学的发展中占有独特的地位。
(1)硼元素有10B和11B两种天然稳定同位素,在基态11B原子中,价电子中存在______ 对自旋方向相反的电子。第一电离能介于B与N之间的第二周期元素有______ 种。
(2)目前已制得二十多种硼氢化合物,如乙硼烷B2H6、丁硼烷B4H10等在能源方面前景可期。
①NH3能通过配位键与硼元素的某种氢化物作用得到化合物M, M是一种新的储氢材料,加热M 会缓慢释放出H2,并转化为化合物N, M、N分别是乙烷、乙烯的等电子体。M的结构式为______ 须标出配位键),氮原子在M、N分子中的杂化方式分别为_________ 。
②B2H6可作火箭燃料,将B2H6气体通入H2O中的反应为B2H6+6H20=2H3BO3+6H2↑,据此可判断反应中所涉及元素的电负性从小到顺序为_________ 。
③以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,可将竣基直接还原成醇。
CH3C00H CH3CH2OH
CH3CH2OH 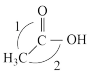
上图中乙酸分子键角1>键角2,其原因为_____________ 。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,如图1所示。
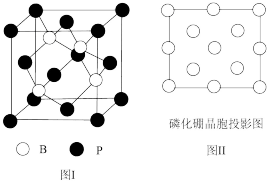
①图II是磷化硼沿Z轴的投影图,请在图II中圆球上涂“ ”和画“×”分别表明B与P的相对位置
”和画“×”分别表明B与P的相对位置_____________ 。
②已知晶胞边长为apm,则磷化硼的密度是______ g/cm3(只要求列算式)。
(1)硼元素有10B和11B两种天然稳定同位素,在基态11B原子中,价电子中存在
(2)目前已制得二十多种硼氢化合物,如乙硼烷B2H6、丁硼烷B4H10等在能源方面前景可期。
①NH3能通过配位键与硼元素的某种氢化物作用得到化合物M, M是一种新的储氢材料,加热M 会缓慢释放出H2,并转化为化合物N, M、N分别是乙烷、乙烯的等电子体。M的结构式为
②B2H6可作火箭燃料,将B2H6气体通入H2O中的反应为B2H6+6H20=2H3BO3+6H2↑,据此可判断反应中所涉及元素的电负性从小到顺序为
③以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,可将竣基直接还原成醇。
CH3C00H
 CH3CH2OH
CH3CH2OH 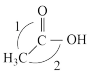
上图中乙酸分子键角1>键角2,其原因为
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,如图1所示。

①图II是磷化硼沿Z轴的投影图,请在图II中圆球上涂“
 ”和画“×”分别表明B与P的相对位置
”和画“×”分别表明B与P的相对位置②已知晶胞边长为apm,则磷化硼的密度是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】卤族元素是典型的非金属元素,包括F,Cl,Br,I等.请回答下面有关问题:
(1)同主族元素的电负性大小存在一定的规律,卤族元素F,Cl,Br,I的电负性由小到大 的顺序是_______ ;
(2)Br原子的核外电子排布式为_______ ;
(3)用价层电子对互斥理论判断BeCl2的构型为_______ ,BF3分子中B﹣F键的键角为_______ ;
(4)CCl4分子中碳原子的杂化方式为_______ ,NF3分子的空间构型为_______ ;
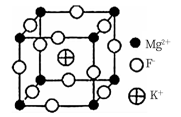
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为_______ 。
(1)同主族元素的电负性大小存在一定的规律,卤族元素F,Cl,Br,I的电负性由小到大 的顺序是
(2)Br原子的核外电子排布式为
(3)用价层电子对互斥理论判断BeCl2的构型为
(4)CCl4分子中碳原子的杂化方式为
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为

您最近一年使用:0次



