2020高三·全国·专题练习
名校
解题方法
1 . (1)下列状态的镁中,电离最外层一个电子所需能量最大的是________ (填标号)。
A.[Ne]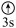 B.[Ne]
B.[Ne] 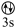 C.[Ne]
C.[Ne]  D.[Ne]
D.[Ne] 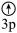
(2)Fe成为阳离子时首先失去________ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________ 。
(3)Cu2+基态核外电子排布式为__________________ 。
(4)Mn位于元素周期表中第四周期________ 族,基态Mn原子核外未成对电子有________ 个。
(5)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____ 、_____ (填标号)。
A.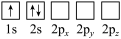 B.
B. 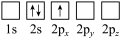
C.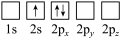 D.
D. 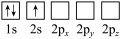
A.[Ne]
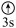 B.[Ne]
B.[Ne]  C.[Ne]
C.[Ne]  D.[Ne]
D.[Ne] 
(2)Fe成为阳离子时首先失去
(3)Cu2+基态核外电子排布式为
(4)Mn位于元素周期表中第四周期
(5)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. 
C.
 D.
D. 
您最近一年使用:0次
2020-12-09更新
|
2595次组卷
|
5卷引用:易错24 原子核外电子排布式-备战2021年高考化学一轮复习易错题
(已下线)易错24 原子核外电子排布式-备战2021年高考化学一轮复习易错题四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)河北省唐山市曹妃甸区第一中学2020-2021学年高二下学期6月月考化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题
名校
2 . 周期表前四周期的元素a、b、c、d、e,f原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的外围电子排布式为3d64s2,f的最外层只有一个电子,但次外层有18个电子.回答下列问题:
(1)a、d、e、f各元素分别是_________ 、_______ 、_______ 、_______ 。
(2)b、c、d中第一电离能由大到小的顺序是:_______________ (填元素符号),f的价层电子轨道示意图为_________________________________ ,f的焰色反应为亮绿色,请用原子结构的知识解释原因___________________ ,预测电离能I4(e)_______ I4(f)的大小(填大于、小于、等于)。
(3)a和b、c、d形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为__________ ;
(4)f2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[f(NH3)4]2+中存在的化学键类型有________ (填序号)。
A.配位键B.极性共价键C.非极性共价键D.离子键
②写出[f(NH3)4]2+的结构式____________ 。(只标出配位键)
(1)a、d、e、f各元素分别是
(2)b、c、d中第一电离能由大到小的顺序是:
(3)a和b、c、d形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为
(4)f2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[f(NH3)4]2+中存在的化学键类型有
A.配位键B.极性共价键C.非极性共价键D.离子键
②写出[f(NH3)4]2+的结构式
您最近一年使用:0次
3 . 下图是元素周期表的简略框架图。

(1)请在上图所示的元素周期表中画出金属元素与非金属元素的分界线__ 。元素周期表的5个区中,不全是金属元素的区为__ 。
(2)根据氢元素最高正化合价与最低负化合价的绝对值相等,你认为还可把氢元素放在元素周期表中的_____ 族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实:____ 。
(3)上图中元素①②的原子价电子排布式分别为___ 、____ 。比较元素①与元素②的下列性质(填“>”或“<”)。原子半径:①_____ ②;电负性:①____ ②;金属性:①_____ ②;第一电离能:①_____ ②。
(4)某短周期元素最高正化合价为+7,其电子排布式为____

(1)请在上图所示的元素周期表中画出金属元素与非金属元素的分界线
(2)根据氢元素最高正化合价与最低负化合价的绝对值相等,你认为还可把氢元素放在元素周期表中的
(3)上图中元素①②的原子价电子排布式分别为
(4)某短周期元素最高正化合价为+7,其电子排布式为
您最近一年使用:0次
4 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:
(1)写出下列元素的符号:B_____ 、C_____ 。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是____ ,电负性最大的元素是____ 。
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在____ 区。
(4)写出A的核外电子排布式_____ 。
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:(1)写出下列元素的符号:B
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在
(4)写出A的核外电子排布式
您最近一年使用:0次
2020-10-24更新
|
287次组卷
|
3卷引用:四川省平昌县驷马中学2020-2021学年高二上学期10月月考化学试题
四川省平昌县驷马中学2020-2021学年高二上学期10月月考化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题(已下线)第01章 原子结构与元素性质(B卷能力提升篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)
解题方法
5 . 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
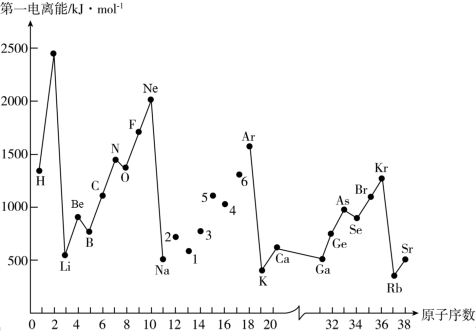
请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象______ 。
(2)从图中分析可知,同一主族元素原子的第一电离能I1变化规律是_______ ;
(3)图中5号元素在周期表中的位置是_________ ;
(4)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是_______ 。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)

请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象
(2)从图中分析可知,同一主族元素原子的第一电离能I1变化规律是
(3)图中5号元素在周期表中的位置是
(4)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
您最近一年使用:0次
2020-09-30更新
|
189次组卷
|
3卷引用:四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题
四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题(已下线)1.2 原子结构与元素的性质(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)广东省韶关实验中学2021-2022学年高二下学期第一次月考化学试题
名校
6 . [化学——选修3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)e原子的价层电子排布图为____________
(2)晶体d、晶体da晶体ac2的熔点由高到低的顺序为____________ (用化学用语表示,下同),a、b、c三种元素的第一电离能由大到小的顺序为________________________ 。
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为____________ ,bc3-离子的空间构型为____________ 。
(4)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体。请写出得到深蓝色透明溶液的离子方程式________________________ ,析出深蓝色晶体时加入乙醇的作用是________________________ 。
(5)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为____________ g·cm3。(用含NA、r的表达式表示)

周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)e原子的价层电子排布图为
(2)晶体d、晶体da晶体ac2的熔点由高到低的顺序为
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为
(4)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体。请写出得到深蓝色透明溶液的离子方程式
(5)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为

您最近一年使用:0次
2020-09-09更新
|
426次组卷
|
3卷引用:【市级联考】四川省内江市2019届高三上学期第一次模拟考试理科综合化学试题
解题方法
7 . ⑴可正确表示原子轨道的是___ 。
A.2s B.2d C.3p D.3f
⑵写出基态镓(Ga)原子的电子排布式:___ 。
⑶下列物质变化,只与范德华力有关的是___ 。
A.干冰熔化 B.乙酸汽化 C.乙醇与丙酮混溶 D. 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
⑷下列物质中,只含有极性键的分子是___ ,既含离子键又含共价键的化合物是___ ;只存在σ键的分子是___ ,同时存在σ键和π键的分子是___ 。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
⑸用“>”“<”或“=”填空:
第一电离能的大小:Mg___ Al;熔点的高低:KCl___ MgO。
A.2s B.2d C.3p D.3f
⑵写出基态镓(Ga)原子的电子排布式:
⑶下列物质变化,只与范德华力有关的是
A.干冰熔化 B.乙酸汽化 C.乙醇与丙酮混溶 D.
 溶于水
溶于水E.碘溶于四氯化碳 F.石英熔融
⑷下列物质中,只含有极性键的分子是
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
⑸用“>”“<”或“=”填空:
第一电离能的大小:Mg
您最近一年使用:0次
2020-06-23更新
|
171次组卷
|
2卷引用:四川省成都市简阳市阳安中学2020-2021学年高二上学期11月月考化学试题
解题方法
8 . 磷化硼(BP)是一种受到高度关注的金属保护层耐磨材料,可由三溴化硼和三溴化磷在氢气中高温制得。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为____ ,核外电子数最多的元素的基态原子电子占据最高能级上的电子数为____ 。B所在的周期第一电离能最大的元素名称为____ 。
(2)三溴化磷分子的中心原子价层电子对数为____ ,分子空间结构为____ 形。BBr3空间结构为____ 形,PBr3分子中键角比BBr3分子中键角____ (填>、<或=)。
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJ•mol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJ•mol-1,这种固体高聚氮可能潜在的用途是____ ,这是因为____ 。
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为____ ,已知晶胞参数a=478pm,则硼和磷原子的核间距为____ pm(保留整数)。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为
(2)三溴化磷分子的中心原子价层电子对数为
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJ•mol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJ•mol-1,这种固体高聚氮可能潜在的用途是
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为
您最近一年使用:0次
9 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
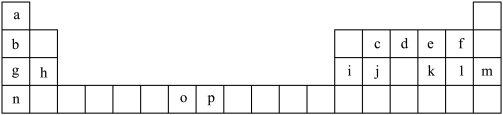
(1)基态o原子的外围电子排布图________________________ ;基态p3+的最外层电子排布式___________________ ;n的原子结构示意图____________________ 。在以上元素中,没有未成对电子的元素有______ 种。
(2)原子序数为52的元素x在元素周期表中与以上________________ 元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__ I3(p)(填“>”或“<”)。理由是_________________________________________________ 。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________ (用元素符号表示),第一电离能由大到小排序________________________ (用元素符号表示)。

(1)基态o原子的外围电子排布图
(2)原子序数为52的元素x在元素周期表中与以上
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序
您最近一年使用:0次
10 . 金属氢化物是具有良好发展前景的储氢材料。
(1)LiH中,离子半径:Li+_________ H-(填“>”、“=”或“<”)。
(2)某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是_________ (填元素符号)。
(3)CH4、NH3、H2O、BCl3、HF分子中键角大小顺序是_____ 。
(4)有以下物质:①H2O,②NaOH,③H2O2,④H2,⑤C2H4,⑥Ar,⑦Na2O2,⑧HCN,既有σ键又有π键的是_____________________ ;只含有σ键的是__________ ;含有由两个原子的s轨道重叠形成的σ键的是________ ;不存在化学键的是________ ;含有离子键和非极性键的是_________ 。
(1)LiH中,离子半径:Li+
(2)某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)CH4、NH3、H2O、BCl3、HF分子中键角大小顺序是
(4)有以下物质:①H2O,②NaOH,③H2O2,④H2,⑤C2H4,⑥Ar,⑦Na2O2,⑧HCN,既有σ键又有π键的是
您最近一年使用:0次



