1 . 磷酸亚铁锂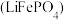 和锰酸锂
和锰酸锂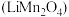 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:
(1)基态O原子的价电子轨道表示式为___________ ;Mn的原子结构示意图为___________ 。
(2) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) 。
。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性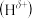 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性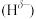 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是___________ 。
(4)已知: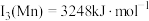 ,
,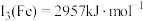 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过螯合作用 形成的配位键有___________ mol。
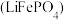 和锰酸锂
和锰酸锂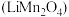 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:(1)基态O原子的价电子轨道表示式为
(2)
 的熔、沸点
的熔、沸点 。
。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性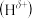 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性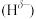 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是(4)已知:
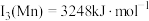 ,
,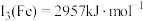 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过
您最近一年使用:0次
2 . 绿芦笋中含有天门冬氨酸(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。回答下列问题:____ (填“σ键”、“π键”),其中N原子的杂化轨道类型为_____ ,图中O—C—C的键角____ C—C—N的键角(填“大于”或“小于”)。
(2)H2S和H2Se热稳定性较好的是_______ ,从分子结构角度解释其原因:______ 。
(3)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的—NH2,换成—NO2,得到的新物质的酸性会增强,原因是_______ 。
(4)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIA族元素简单氢化物沸点变化的是曲线_______ (填字母),用分子间作用力解释该曲线:_____ 。O−H∙∙∙O的键能小于F−H∙∙∙F,但水的沸点高于HF的原因可能是_______ 。

(2)H2S和H2Se热稳定性较好的是
(3)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的—NH2,换成—NO2,得到的新物质的酸性会增强,原因是
(4)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIA族元素简单氢化物沸点变化的是曲线

| 氢键X−H∙∙∙Y | 键能/(kJ·mol-1) | 键长/pm | 代表性例子 |
| F−H∙∙∙F | 28.1 | 255 | (HF)n |
| O−H∙∙∙O | 18.8 | 276 | 冰 |
| O−H∙∙∙O | 25.9 | 266 | 甲醇,乙醇 |
| N−H∙∙∙F | 20.9 | 268 | NH4F |
| N−H∙∙∙O | 20.9 | 286 | CH3CONH2 |
| N−H∙∙∙N | 5.4 | 338 | NH3 |
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.硒化锌是一种透明半导体,也可作为红外光学材料,熔点是1520℃。
(1)基态锌原子的价电子排布式是_____ 。
(2)根据元素周期律,电负性Se_____ S,Se位于周期表_____ 区。
(3)H2Se的分子构型是_____ ,其中硒原子的杂化轨道类型是_____ 。
(4)H2O的沸点高于H2Se的沸点(-42℃),其原因是_____ 。
Ⅱ.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(5)C、N、O三种元素第一电离能从大到小的顺序是_____ 。
(6)1molN2F2含有_____ molσ键。
(1)基态锌原子的价电子排布式是
(2)根据元素周期律,电负性Se
(3)H2Se的分子构型是
(4)H2O的沸点高于H2Se的沸点(-42℃),其原因是
Ⅱ.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(5)C、N、O三种元素第一电离能从大到小的顺序是
(6)1molN2F2含有
您最近一年使用:0次
名校
解题方法
4 . 根据物质结构的有关性质和特点,回答下列问题:
(1)基态氧原子的价电子排布图为___________ ,基态镁原子核外有种能量不同的电子,Cr3+基态核外电子排布式为___________ 。
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是___________ ,H、C、N元素电负性由大到小的顺序为___________ 。
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为___________ ,碳、氮、氧、氟元素的第三电离能从小到大的顺序为___________ 。
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的___________ 区,Sm3+价层电子排布式为___________ 。
(5)雌黄的分子式为As2S3,其分子结构为 ,As原子的杂化类型为
,As原子的杂化类型为___________ 。
(6)LiBH4由Li+和BH 构成,BH
构成,BH 的立体构型是
的立体构型是___________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为___________ 。
(1)基态氧原子的价电子排布图为
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的
(5)雌黄的分子式为As2S3,其分子结构为
 ,As原子的杂化类型为
,As原子的杂化类型为(6)LiBH4由Li+和BH
 构成,BH
构成,BH 的立体构型是
的立体构型是
您最近一年使用:0次
名校
5 . 哈尔滨工业大学的李惠等人和加州大学洛杉矶分校的黄昱、段镶锋合作合成了具备超轻、高力学强度和超级隔热三大特点的氮化硼(hBNAGs)以及碳化硅( -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
(1)硅原子的价电子排布图为___________ 。B、N、O、Al的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。
① 从原子结构分析B容易与配体形成配位键的原因___________ 。
② 下列有关硼酸及其相关化合物的说法正确的是___________ (填标号)。
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
① 下列有关氨硼烷(NH3BH3)的说法中错误的是___________ (填标号)。
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷的电子式为___________ ,氨硼烷中H−N−H的键角___________ (填“>”“<”或“=”)H−B−H的键角。
 -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:(1)硅原子的价电子排布图为
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF
 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。① 从原子结构分析B容易与配体形成配位键的原因
② 下列有关硼酸及其相关化合物的说法正确的是
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
| 元素符号 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
① 下列有关氨硼烷(NH3BH3)的说法中错误的是
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷的电子式为
您最近一年使用:0次
6 . 钴单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为_______ 。
(2) 元素的第四电离能比铁元素的第四电离能小,理由是
元素的第四电离能比铁元素的第四电离能小,理由是_______ 。
(3)以甲醇为溶剂, 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为_______ (填元素符号),色胺酮分子中N原子的杂化类型有_______ ,X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个 分子,
分子, 通过
通过_______ 作用与色胺酮钴配合物相结合。

(4)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含 原子数为
原子数为_______ ;晶胞底面呈正六边形,边长为 ,设
,设 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为_______  (列出计算式)。
(列出计算式)。

(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)
 元素的第四电离能比铁元素的第四电离能小,理由是
元素的第四电离能比铁元素的第四电离能小,理由是(3)以甲醇为溶剂,
 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为 分子,
分子, 通过
通过
(4)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含
 原子数为
原子数为 ,设
,设 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023高三·全国·专题练习
7 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为_______ 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。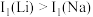 ,原因是
,原因是_______ 。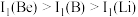 ,原因是
,原因是_______ 。
(1)基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。
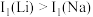 ,原因是
,原因是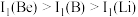 ,原因是
,原因是 | ||
 520 |  900 | B 801 |
 496 |  738 |  578 |
您最近一年使用:0次
解题方法
8 . ①~5五种元素在元素周期表中的位置关系如图:
回答下列问题:
(1)①的元素名称是_______ 。
(2)④的基态原子的电子排布式是_______ 。
(3)②和③中,电负性较大的是_______ (填元素符号)。
(4)②和⑤中,第一电离能较大的是_______ (填元素符号)。
(5)②、③、⑤分别与①形成的最简单化合物中,热稳定性最强的是_______ (填化学式)。
| 族周期 | IA | II A | III A | IVA | VA | VIA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ |
(1)①的元素名称是
(2)④的基态原子的电子排布式是
(3)②和③中,电负性较大的是
(4)②和⑤中,第一电离能较大的是
(5)②、③、⑤分别与①形成的最简单化合物中,热稳定性最强的是
您最近一年使用:0次
名校
解题方法
9 . Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧产生的黄光是一种_______ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是_______ ,能量最低的是_______ (填序号)
a.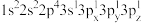 b.
b.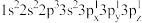 c.
c.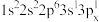 d.1s22s22p63s2
d.1s22s22p63s2
(3)Ti原子核外共有_______ 种运动状态不同的电子,最高能层电子的电子云轮廓形状为_______ 。与Ti同周期的所有过渡元素的基态原子中,写出任意一种最外层电子数与钛不同的元素外围电子排布式_______ 。
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是_______ ,判断理由是_______ 。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。Fe3+与Fe2+的离子半径大小关系为:Fe3+_______ Fe2+(填“大于”或“小于”),原因为:_______ 。
(1)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
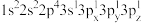 b.
b.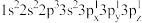 c.
c.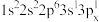 d.1s22s22p63s2
d.1s22s22p63s2(3)Ti原子核外共有
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是
| 元素 | I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 |
| X | 737.7 | 1 450.7 | 7 732.7 |
| Y | 1 313.9 | 3 388.3 | 5 300.5 |
| Z | 1 402.3 | 2 856.0 | 4 578.1 |
您最近一年使用:0次
名校
解题方法
10 . 白铜是以镍为主要添加元素的铜基合金,呈银白色,有金属光泽,故名白铜。云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1) 的核外电子排布式为
的核外电子排布式为_______ ,3d能级上的未成对的电子数为_______ 。
(2)硫酸镍溶于氨水形成蓝色的 溶液。
溶液。
①在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ (用元素符表示)。
②氨极易溶于 ,除因为它们都是极性分子外,还因为
,除因为它们都是极性分子外,还因为_______ 。
(3)单质铜的堆积方式为_______ ;元素铜与镍的第二电离能分别为: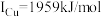 ,
,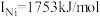 ,
,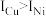 的原因是
的原因是_______ 。
(1)
 的核外电子排布式为
的核外电子排布式为(2)硫酸镍溶于氨水形成蓝色的
 溶液。
溶液。①在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为②氨极易溶于
 ,除因为它们都是极性分子外,还因为
,除因为它们都是极性分子外,还因为(3)单质铜的堆积方式为
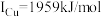 ,
,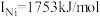 ,
,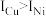 的原因是
的原因是
您最近一年使用:0次



