1 . 2020年,智能材料已大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应 的产物分子中形成配位键提供孤电子对的配位原子名称是
的产物分子中形成配位键提供孤电子对的配位原子名称是______ 。
(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子价电子排布图为______ ,第一电离能介于硼和氮之间的第二周期元素有______ 种。
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于______ (周期,族,区),钛(Ti)的基态原子M能层中有______ 种空间运动状态的电子。
(4)镍能形成多种配合物,如正四面体形的 和正方形的
和正方形的 、正八面体形的
、正八面体形的 等。下列说法正确的有
等。下列说法正确的有______ (填标号)。
A.CO与 互为等电子体,其中CO分子内
互为等电子体,其中CO分子内 键和
键和 键个数之比为1∶2
键个数之比为1∶2
B. 在形成配合物时,其配位数只能为4
在形成配合物时,其配位数只能为4
C.沸点: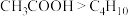 ,因为
,因为 分子间范德华力更强
分子间范德华力更强
D.键角: ,因为
,因为 的成键电子对间的排斥力更大
的成键电子对间的排斥力更大
E.极性:F―C>Cl―C,因此酸性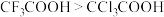
(5)一种四方结构( )的超导化合物汞钡铜氧晶体的晶胞如图所示。
)的超导化合物汞钡铜氧晶体的晶胞如图所示。______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应
 的产物分子中形成配位键提供孤电子对的配位原子名称是
的产物分子中形成配位键提供孤电子对的配位原子名称是(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子价电子排布图为
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于
(4)镍能形成多种配合物,如正四面体形的
 和正方形的
和正方形的 、正八面体形的
、正八面体形的 等。下列说法正确的有
等。下列说法正确的有A.CO与
 互为等电子体,其中CO分子内
互为等电子体,其中CO分子内 键和
键和 键个数之比为1∶2
键个数之比为1∶2B.
 在形成配合物时,其配位数只能为4
在形成配合物时,其配位数只能为4C.沸点:
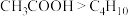 ,因为
,因为 分子间范德华力更强
分子间范德华力更强D.键角:
 ,因为
,因为 的成键电子对间的排斥力更大
的成键电子对间的排斥力更大E.极性:F―C>Cl―C,因此酸性
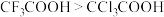
(5)一种四方结构(
 )的超导化合物汞钡铜氧晶体的晶胞如图所示。
)的超导化合物汞钡铜氧晶体的晶胞如图所示。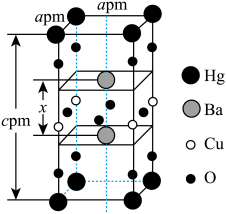
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2 .  、
、 、
、 三种元素性质非常相似,称铁系元素。请回答下列问题。
三种元素性质非常相似,称铁系元素。请回答下列问题。
(1)三种元素位于周期表中______ 区(填分区),基态 原子的外围电子轨道表达式为
原子的外围电子轨道表达式为______ 。
(2) 成为阳离子首先失去
成为阳离子首先失去______ 轨道电子; 、
、 的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是
的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是______ 的熔点,理由是______ 。
(3) 常作净水剂和补铁剂,
常作净水剂和补铁剂, 空间构型为
空间构型为______ ,与其互为等电子体的分子有______ (写一个)。
(4) 的结构如图1所示(略去
的结构如图1所示(略去 原子)(Y是乙二胺四乙酸,分子式为
原子)(Y是乙二胺四乙酸,分子式为 )。该图中四种元素第一电离能由大到小的顺序为
)。该图中四种元素第一电离能由大到小的顺序为______ (写元素符号),其中 原子的杂化类型为
原子的杂化类型为______ 。 该配合物中配位键有
该配合物中配位键有______ mol。 晶体为
晶体为 型结构(如图2)。其中
型结构(如图2)。其中 可看成填充在由
可看成填充在由 组成的正
组成的正______ 面体空隙中,填充率为 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为 ,成为
,成为 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有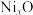 晶胞的质量为
晶胞的质量为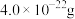 。则分别填充
。则分别填充 、
、 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为______ 。
 、
、 、
、 三种元素性质非常相似,称铁系元素。请回答下列问题。
三种元素性质非常相似,称铁系元素。请回答下列问题。(1)三种元素位于周期表中
 原子的外围电子轨道表达式为
原子的外围电子轨道表达式为(2)
 成为阳离子首先失去
成为阳离子首先失去 、
、 的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是
的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是(3)
 常作净水剂和补铁剂,
常作净水剂和补铁剂, 空间构型为
空间构型为(4)
 的结构如图1所示(略去
的结构如图1所示(略去 原子)(Y是乙二胺四乙酸,分子式为
原子)(Y是乙二胺四乙酸,分子式为 )。该图中四种元素第一电离能由大到小的顺序为
)。该图中四种元素第一电离能由大到小的顺序为 原子的杂化类型为
原子的杂化类型为 该配合物中配位键有
该配合物中配位键有
 晶体为
晶体为 型结构(如图2)。其中
型结构(如图2)。其中 可看成填充在由
可看成填充在由 组成的正
组成的正 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为 ,成为
,成为 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有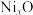 晶胞的质量为
晶胞的质量为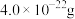 。则分别填充
。则分别填充 、
、 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为
您最近一年使用:0次
名校
解题方法
3 . 已知A、B、C、D、E、M是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。M是第四周期元素中未成对电子数最多的元素。
请用元素符号完成下列空白:
(1)B、C、D、E四种元素中,简单离子半径最小的离子符号是___________ 。
(2)BC 的中心原子的价层电子对数为
的中心原子的价层电子对数为___________ ,VSEPR模型名称为___________ 。
(3)下表是A~M元素中某种元素的部分电离能,由此可判断该元素是___________ 。根据对角线规则,在短周期元素中,该元素的一些化学性质与元素___________ 的相似。
(4)某含M、Ca(钙)、O(氧)的化合物的立方晶胞如图所示。___________ 区,其基态原子的价层电子排布式为___________ 。
②该化合物的化学式是___________ 。
③Ca和M的最近距离为acm,晶体密度为ρg·cm-3。则阿伏加德罗常数(NA)为___________ mol-1(用代数式表示)。
请用元素符号完成下列空白:
(1)B、C、D、E四种元素中,简单离子半径最小的离子符号是
(2)BC
 的中心原子的价层电子对数为
的中心原子的价层电子对数为(3)下表是A~M元素中某种元素的部分电离能,由此可判断该元素是
| 某种元素 | 电离能I(kJ·mol-1) | ||||
| I1 | I2 | I3 | I4 | I5 | |
| 578 | 1817 | 2745 | 11575 | 14830 | |
(4)某含M、Ca(钙)、O(氧)的化合物的立方晶胞如图所示。

②该化合物的化学式是
③Ca和M的最近距离为acm,晶体密度为ρg·cm-3。则阿伏加德罗常数(NA)为
您最近一年使用:0次
解题方法
4 . 2023年化学诺贝尔奖授予了三位研究量子点的科学家。量子点又称“人造原子”、“超原子”,是一种纳米级的半导体材料,在医疗,科技等多个领域有广泛的应用。
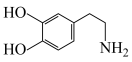
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。___________ ,其最高能层上有___________ 种运动状态不同的电子。
②多巴胺分子中碳原子的杂化方式为___________ ,1mol多巴胺中含有 键的数目为
键的数目为___________ 。
③多巴胺易溶于水,原因是___________ 。
(2)聚多巴胺量子点还可以通过吸附金属离子如 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。
① 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为___________ 。
②Mn的第三电离能大于Fe的第三电离能,原因是___________ 。
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如下图所示。 的配位数为
的配位数为___________ 。
②若CdS晶体的密度为 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为___________ pm(列出计算式即可)。
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。
②多巴胺分子中碳原子的杂化方式为
 键的数目为
键的数目为③多巴胺易溶于水,原因是
(2)聚多巴胺量子点还可以通过吸附金属离子如
 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。①
 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为②Mn的第三电离能大于Fe的第三电离能,原因是
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如下图所示。

 的配位数为
的配位数为②若CdS晶体的密度为
 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为
您最近一年使用:0次
解题方法
5 . 乙醚是一种极易挥发的无色透明液体。乙醚长时间与空气接触时,逐渐生成过氧化乙醚( )。
)。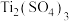 、
、 、
、 可除去过氧化乙醚。回答下列问题:
可除去过氧化乙醚。回答下列问题:
(1)基态 、O、
、O、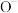 的第一电离能
的第一电离能 按由大到小排序为
按由大到小排序为___________ 。
(2)基态 还原过氧化乙醚时失去的是
还原过氧化乙醚时失去的是___________ 轨道电子,从电负性角度判断 中H的化合价为
中H的化合价为___________ 。 中
中 键的化学键类型为
键的化学键类型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)一个过氧化乙醚分子中,价层电子对数目为4的原子有___________ 个。过氧化乙醚分子中的键能如下:
造成 键键能小于
键键能小于 键键能的可能原因是
键键能的可能原因是___________ 。
(4)乙醚沸点35.6℃,丙酸( )沸点为141℃,两者沸点差异较大的主要原因是
)沸点为141℃,两者沸点差异较大的主要原因是___________ 。
(5)硫酸亚铁的正交晶胞参数为 、
、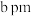 、
、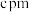 ,
,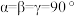 ,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为
,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为 。
。___________  ,晶体密度为
,晶体密度为___________  (列出算式)。
(列出算式)。
 )。
)。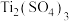 、
、 、
、 可除去过氧化乙醚。回答下列问题:
可除去过氧化乙醚。回答下列问题:(1)基态
 、O、
、O、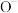 的第一电离能
的第一电离能 按由大到小排序为
按由大到小排序为(2)基态
 还原过氧化乙醚时失去的是
还原过氧化乙醚时失去的是 中H的化合价为
中H的化合价为 中
中 键的化学键类型为
键的化学键类型为(3)一个过氧化乙醚分子中,价层电子对数目为4的原子有
| 单键 |  |  |  |  |  |
键能/( ) ) | 346 | 411 | 358 | 207 | 459 |
 键键能小于
键键能小于 键键能的可能原因是
键键能的可能原因是(4)乙醚沸点35.6℃,丙酸(
 )沸点为141℃,两者沸点差异较大的主要原因是
)沸点为141℃,两者沸点差异较大的主要原因是(5)硫酸亚铁的正交晶胞参数为
 、
、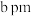 、
、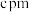 ,
,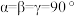 ,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为
,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为 。
。
 ,晶体密度为
,晶体密度为 (列出算式)。
(列出算式)。
您最近一年使用:0次
解题方法
6 . 钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为_______ 。
(2)区分晶态 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是_______ , 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_______ 。
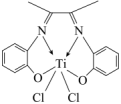
(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。______ ,其中碳原子的杂化方式为_______ 。
②该配合物中心离子是_______ ,0.5mol配合物中含 键的数目为
键的数目为_______ 。
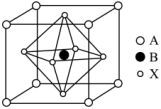
(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子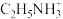 ,另两种离子为
,另两种离子为 和
和 。
。_______ 。
②与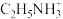 紧邻等距的
紧邻等距的 数为
数为_______ 。
③晶胞中两个最近的 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)区分晶态
 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
②该配合物中心离子是
 键的数目为
键的数目为(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子
 ,另两种离子为
,另两种离子为 和
和 。
。
②与
 紧邻等距的
紧邻等距的 数为
数为③晶胞中两个最近的
 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
7 . 材料的发展是电池性能优化的关键,根据相关电池材料回答下列问题:
(1)双(三氟甲基磺酰)亚胺锂( )是电池电解液成分之一,涉及的非金属原子的第一电离能最大的是
)是电池电解液成分之一,涉及的非金属原子的第一电离能最大的是_______ 。以上C、N、Li元素的简单氢化物中,熔点最低的是_______ (填化学式),原因是_______ 。
(2)二甲亚砜( )是电池电解液溶剂之一,分子中C、O、S的四个原子构成的空间构型为
)是电池电解液溶剂之一,分子中C、O、S的四个原子构成的空间构型为_______ (选填“平面三角形”或“三角锥形”)。二甲亚砜被誉为“万能溶剂”,能溶解大多数水溶性化合物和脂溶性化合物,是因为其结构中具有亲水的基团_______ (填基团结构简式,下同)和亲油的基团_______ 。
(3)一种新型锂离子电池正极复合材料,其晶胞结构如图所示(所有原子均位于晶胞的棱、顶点和内部),基态Co原子的价电子轨道表示式为_______ ;一个晶胞中含有_______ 个Co原子;该晶体密度为_______ g/cm3(用含a、b的式子表示)。
(1)双(三氟甲基磺酰)亚胺锂(
 )是电池电解液成分之一,涉及的非金属原子的第一电离能最大的是
)是电池电解液成分之一,涉及的非金属原子的第一电离能最大的是(2)二甲亚砜(
 )是电池电解液溶剂之一,分子中C、O、S的四个原子构成的空间构型为
)是电池电解液溶剂之一,分子中C、O、S的四个原子构成的空间构型为(3)一种新型锂离子电池正极复合材料,其晶胞结构如图所示(所有原子均位于晶胞的棱、顶点和内部),基态Co原子的价电子轨道表示式为

您最近一年使用:0次
8 . 镁 可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
(1)基态 原子的核外电子有
原子的核外电子有_______ 种空间运动状态,在元素周期表中, 和
和 均与
均与 相邻,这三种元素第一电离能由大到小的顺序是
相邻,这三种元素第一电离能由大到小的顺序是_______ 。
(2) 可用于
可用于 的冶炼:
的冶炼: ,基态
,基态 的价电子排布图(轨道表示式)为
的价电子排布图(轨道表示式)为_______ , 的熔点
的熔点 比
比 (714
(714 )低,其原因是
)低,其原因是_______ 。
(3)大黄素的分子结构如图所示,其中碳原子的杂化轨道类型是_______ ,分子中至少有_______ 个原子共平面,一定条件下,大黄素分子中的_______ 原子能提供孤对电子与 形成配位键。
形成配位键。 和
和 三种元素组成的晶体
三种元素组成的晶体 ,其立方晶胞如图,
,其立方晶胞如图, 与
与 的最小核间距大于
的最小核间距大于 与
与 的最小核间距,
的最小核间距, 与
与 为整数,则
为整数,则 在晶胞中的位置为
在晶胞中的位置为_______ , 的配位数是
的配位数是_______ ,若晶胞参数为 ,则晶体密度
,则晶体密度
_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:(1)基态
 原子的核外电子有
原子的核外电子有 和
和 均与
均与 相邻,这三种元素第一电离能由大到小的顺序是
相邻,这三种元素第一电离能由大到小的顺序是(2)
 可用于
可用于 的冶炼:
的冶炼: ,基态
,基态 的价电子排布图(轨道表示式)为
的价电子排布图(轨道表示式)为 的熔点
的熔点 比
比 (714
(714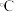 )低,其原因是
)低,其原因是(3)大黄素的分子结构如图所示,其中碳原子的杂化轨道类型是
 形成配位键。
形成配位键。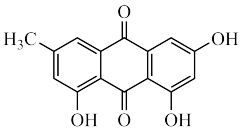
 和
和 三种元素组成的晶体
三种元素组成的晶体 ,其立方晶胞如图,
,其立方晶胞如图, 与
与 的最小核间距大于
的最小核间距大于 与
与 的最小核间距,
的最小核间距, 与
与 为整数,则
为整数,则 在晶胞中的位置为
在晶胞中的位置为 的配位数是
的配位数是 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
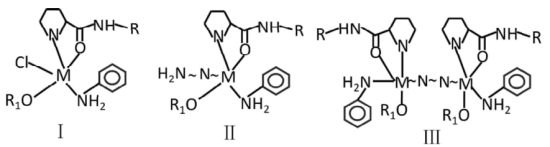
9 . 我国院士合成的冯氏手性双氮氧配体作为优势配体,结构高度可调,与主族金属、过渡金属和稀土金属等形成的配合物已催化众多不对称反应。下图为代表性冯氏配合物I、Ⅱ和Ⅲ。
(1)M若为与氮同主族的锑原子,其基态的价层电子轨道表示式为___________ 。
(2)冯氏配合物I中,M的配位原子有___________ 种,C原子的杂化方式为___________ , 的空间结构呈V形,原因是
的空间结构呈V形,原因是___________ 。
(3)冯氏配合物Ⅱ中,基态配位原子的第一电离能( )由大到小的顺序是
)由大到小的顺序是___________ 。冯氏配合物II、III中M分别代表 和
和 ,则冯氏配合物II、I和氮气三者中,两个氮原子间键长最长的是
,则冯氏配合物II、I和氮气三者中,两个氮原子间键长最长的是___________ 。
(4)冯氏配合物中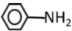 的沸点比
的沸点比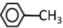 高,原因是
高,原因是___________ 。
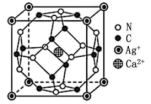
(5)近年来,科学家合成了一种含银的高温超导材料,其晶胞结构如图所示。该立方晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。___________ 。
②晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个。
③该晶体的密度为___________  。
。
 代表
代表 ~代表单键、双键或三键M代表金属原子或金属阳离子
~代表单键、双键或三键M代表金属原子或金属阳离子
(1)M若为与氮同主族的锑原子,其基态的价层电子轨道表示式为
(2)冯氏配合物I中,M的配位原子有
 的空间结构呈V形,原因是
的空间结构呈V形,原因是(3)冯氏配合物Ⅱ中,基态配位原子的第一电离能(
 )由大到小的顺序是
)由大到小的顺序是 和
和 ,则冯氏配合物II、I和氮气三者中,两个氮原子间键长最长的是
,则冯氏配合物II、I和氮气三者中,两个氮原子间键长最长的是(4)冯氏配合物中
 的沸点比
的沸点比 高,原因是
高,原因是(5)近年来,科学家合成了一种含银的高温超导材料,其晶胞结构如图所示。该立方晶胞参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
②晶体中与
 最近且距离相等的
最近且距离相等的 有
有③该晶体的密度为
 。
。
您最近一年使用:0次
10 . 环戊二烯 分子可与金属Na反应形成盐
分子可与金属Na反应形成盐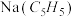 ,该盐与
,该盐与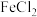 反应生成最著名的夹心化合物——二茂铁
反应生成最著名的夹心化合物——二茂铁 。回答下列问题:
。回答下列问题:
(2)第一电离能
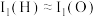 ,从原子结构角度解释
,从原子结构角度解释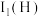
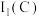 (填“>”或“<”)。
(填“>”或“<”)。(3)已知阴离子
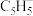 中所有原子共平面,则其中C原子的杂化轨道类型是
中所有原子共平面,则其中C原子的杂化轨道类型是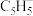 离子配体与1个
离子配体与1个 离子形成的配合物,已知中心离子价电子数与配体提供电子总数之和为18,则每个配体提供
离子形成的配合物,已知中心离子价电子数与配体提供电子总数之和为18,则每个配体提供(4)相比于吡咯(
 ),环戊二烯在水中溶解度远小于吡咯,可能原因是
),环戊二烯在水中溶解度远小于吡咯,可能原因是(5)二茂铁熔点173℃,100℃以上升华,沸点249℃,由此判断二茂铁的晶体类型为
(6)二茂铁隔绝空气受热分解为一种化学式为
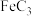 的铁碳合金,其立方晶胞结构如图所示。分析C原子旁最近的Fe原子有
的铁碳合金,其立方晶胞结构如图所示。分析C原子旁最近的Fe原子有
 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次



