名校
解题方法
1 . 根据物质结构的有关性质和特点,回答下列问题:
(1)基态氧原子的价电子排布图为___________ ,基态镁原子核外有种能量不同的电子,Cr3+基态核外电子排布式为___________ 。
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是___________ ,H、C、N元素电负性由大到小的顺序为___________ 。
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为___________ ,碳、氮、氧、氟元素的第三电离能从小到大的顺序为___________ 。
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的___________ 区,Sm3+价层电子排布式为___________ 。
(5)雌黄的分子式为As2S3,其分子结构为 ,As原子的杂化类型为
,As原子的杂化类型为___________ 。
(6)LiBH4由Li+和BH 构成,BH
构成,BH 的立体构型是
的立体构型是___________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为___________ 。
(1)基态氧原子的价电子排布图为
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的
(5)雌黄的分子式为As2S3,其分子结构为
 ,As原子的杂化类型为
,As原子的杂化类型为(6)LiBH4由Li+和BH
 构成,BH
构成,BH 的立体构型是
的立体构型是
您最近一年使用:0次
2 . 钴单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为_______ 。
(2) 元素的第四电离能比铁元素的第四电离能小,理由是
元素的第四电离能比铁元素的第四电离能小,理由是_______ 。
(3)以甲醇为溶剂, 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为_______ (填元素符号),色胺酮分子中N原子的杂化类型有_______ ,X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个 分子,
分子, 通过
通过_______ 作用与色胺酮钴配合物相结合。

(4)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含 原子数为
原子数为_______ ;晶胞底面呈正六边形,边长为 ,设
,设 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为_______  (列出计算式)。
(列出计算式)。

(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)
 元素的第四电离能比铁元素的第四电离能小,理由是
元素的第四电离能比铁元素的第四电离能小,理由是(3)以甲醇为溶剂,
 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为 分子,
分子, 通过
通过
(4)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含
 原子数为
原子数为 ,设
,设 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023高三·全国·专题练习
3 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为_______ 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。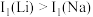 ,原因是
,原因是_______ 。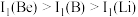 ,原因是
,原因是_______ 。
(1)基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。
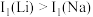 ,原因是
,原因是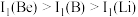 ,原因是
,原因是 | ||
 520 |  900 | B 801 |
 496 |  738 |  578 |
您最近一年使用:0次
名校
解题方法
4 . Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧产生的黄光是一种_______ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是_______ ,能量最低的是_______ (填序号)
a.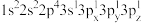 b.
b.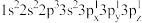 c.
c.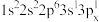 d.1s22s22p63s2
d.1s22s22p63s2
(3)Ti原子核外共有_______ 种运动状态不同的电子,最高能层电子的电子云轮廓形状为_______ 。与Ti同周期的所有过渡元素的基态原子中,写出任意一种最外层电子数与钛不同的元素外围电子排布式_______ 。
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是_______ ,判断理由是_______ 。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。Fe3+与Fe2+的离子半径大小关系为:Fe3+_______ Fe2+(填“大于”或“小于”),原因为:_______ 。
(1)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
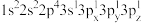 b.
b.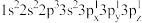 c.
c.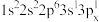 d.1s22s22p63s2
d.1s22s22p63s2(3)Ti原子核外共有
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是
| 元素 | I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 |
| X | 737.7 | 1 450.7 | 7 732.7 |
| Y | 1 313.9 | 3 388.3 | 5 300.5 |
| Z | 1 402.3 | 2 856.0 | 4 578.1 |
您最近一年使用:0次
名校
解题方法
5 . 白铜是以镍为主要添加元素的铜基合金,呈银白色,有金属光泽,故名白铜。云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1) 的核外电子排布式为
的核外电子排布式为_______ ,3d能级上的未成对的电子数为_______ 。
(2)硫酸镍溶于氨水形成蓝色的 溶液。
溶液。
①在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ (用元素符表示)。
②氨极易溶于 ,除因为它们都是极性分子外,还因为
,除因为它们都是极性分子外,还因为_______ 。
(3)单质铜的堆积方式为_______ ;元素铜与镍的第二电离能分别为: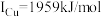 ,
,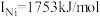 ,
,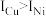 的原因是
的原因是_______ 。
(1)
 的核外电子排布式为
的核外电子排布式为(2)硫酸镍溶于氨水形成蓝色的
 溶液。
溶液。①在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为②氨极易溶于
 ,除因为它们都是极性分子外,还因为
,除因为它们都是极性分子外,还因为(3)单质铜的堆积方式为
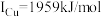 ,
,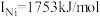 ,
,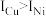 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
6 . 根据要求填空
(1)选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤CaBr2 ⑥NaH ⑦ K3C60 ⑧石墨 ⑨氯化铵 ⑩铜晶体 熔化时不破坏化学键的有_______ ;含有非极性共价键的有_______ 。
(2)性质比较:(填“>”、“=”或“<”,下同)
①第一电离能Mg_______ Al,解释原因_______
②酸性强弱HClO4_______ HClO3,解释原因_______
(3)下图为几种晶体或晶胞的示意图(用名称填写)
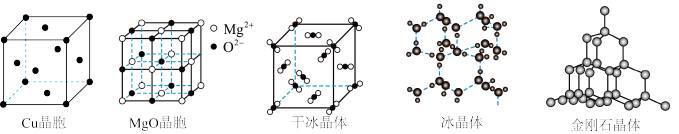
①上述晶体中,粒子之间以共价键结合形成的晶体是_______ 。
②冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为_______ 。
(1)选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤CaBr2 ⑥NaH ⑦ K3C60 ⑧石墨 ⑨氯化铵 ⑩铜晶体 熔化时不破坏化学键的有
(2)性质比较:(填“>”、“=”或“<”,下同)
①第一电离能Mg
②酸性强弱HClO4
(3)下图为几种晶体或晶胞的示意图(用名称填写)

①上述晶体中,粒子之间以共价键结合形成的晶体是
②冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为
您最近一年使用:0次
名校
7 . 某些共价键的键能数据如下表(单位:kJ·mol-1):
(1)把1molCl2分解为气态原子时,需要_______ (填“吸收”或“放出”)_______ kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是_______ ,最不稳定的是_______ ;形成的化合物分子中最稳定的是_______ 。
(3)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)的反应热_______ 。
(4)1919年,Langmuir提出等电子原理:原子总数相同、价电子总数相同的微粒,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,写出一种与 互为等电子体的分子
互为等电子体的分子_______ 。
(5)元素H、N、O第一电离能由小到大的顺序为_______
| 共价键 | H—H | Cl—Cl | Br—Br | H—Cl | H—I |
| 键能 | 436 | 243 | 193 | 432 | 298 |
| 共价键 | I—I | N≡N | H—O | H—N | |
| 键能 | 151 | 946 | 463 | 393 | |
(1)把1molCl2分解为气态原子时,需要
(2)由表中所列化学键形成的单质分子中,最稳定的是
(3)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)的反应热
(4)1919年,Langmuir提出等电子原理:原子总数相同、价电子总数相同的微粒,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,写出一种与
 互为等电子体的分子
互为等电子体的分子(5)元素H、N、O第一电离能由小到大的顺序为
您最近一年使用:0次
名校
8 . I.有下列几种物质:①CH4②N2③CO2④CH3CH3⑤C2H4⑥H2O2。请按要求回答下列问题(填写编号):
(1)只有σ键的有____ ,既有σ键又有π键的有____ 。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为___ 。
II.2019年1月3日,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。其所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(3)基态Ga原子价电子排布式为____ ,核外电子占据最高能级的电子云形状为____ ;基态As原子最高能层上有___ 个电子。
(4)镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____ 和+3,砷的第一电离能比镓___ (填“大”或“小”)。
(5)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为____ 。
(6)砷化镓可由(CH3)3Ga和AsH3在700℃制得,其中AsH3分子的VSEPR模型为____ 。
(7)与砷同主族的氮容易形成三键,但砷却难以形成三键的原因是___ 。
(1)只有σ键的有
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为
II.2019年1月3日,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。其所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(3)基态Ga原子价电子排布式为
(4)镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(5)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为
(6)砷化镓可由(CH3)3Ga和AsH3在700℃制得,其中AsH3分子的VSEPR模型为
(7)与砷同主族的氮容易形成三键,但砷却难以形成三键的原因是
您最近一年使用:0次
名校
9 . 按要求回答下列问题:
(1)研究发现,在 低压合成甲醇反应(
低压合成甲醇反应( )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第_______ 号元素。元素Mn与O中,基态原子核外未成对电子数较多的是_______ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐 。
。
①氮原子的价电子排布式为_______ 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。

其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是_______ ;氮元素的 呈现异常的原因是
呈现异常的原因是_______ 。
(3)已知As元素的相关信息如图所示,下列说法不正确的是_______。

(1)研究发现,在
 低压合成甲醇反应(
低压合成甲醇反应( )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第(2)我国科学家成功合成了世界上首个五氮阴离子盐
 。
。①氮原子的价电子排布式为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能
 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。
其中除氮元素外,其他元素的
 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是(3)已知As元素的相关信息如图所示,下列说法不正确的是_______。

| A.推测As能形成多种氧化物 |
B.热稳定性: 逐渐减弱 逐渐减弱 |
C.As的一种核素表示为 ,中子数为40 ,中子数为40 |
| D.原子半径由大到小的顺序:As、Cl、Si |
您最近一年使用:0次
解题方法
10 . 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。请回答以下问题:
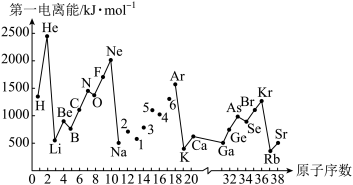
(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象____ 。
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律____ 。
(3)图中5号元素在周期表中的位置是____ 、电子排布____ 。
(4)图中N元素比O元素第一电离能高的原因是____ 。
(5)C、H元素形成的化合物分子中共有14个电子,该分子中____ 个σ键,____ 个π键,中心原子杂化模式____ ,分子空间构型____ 。

(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律
(3)图中5号元素在周期表中的位置是
(4)图中N元素比O元素第一电离能高的原因是
(5)C、H元素形成的化合物分子中共有14个电子,该分子中
您最近一年使用:0次



