名校
解题方法
1 . Ⅰ.硒化锌是一种透明半导体,也可作为红外光学材料,熔点是1520℃。
(1)基态锌原子的价电子排布式是_____ 。
(2)根据元素周期律,电负性Se_____ S,Se位于周期表_____ 区。
(3)H2Se的分子构型是_____ ,其中硒原子的杂化轨道类型是_____ 。
(4)H2O的沸点高于H2Se的沸点(-42℃),其原因是_____ 。
Ⅱ.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(5)C、N、O三种元素第一电离能从大到小的顺序是_____ 。
(6)1molN2F2含有_____ molσ键。
(1)基态锌原子的价电子排布式是
(2)根据元素周期律,电负性Se
(3)H2Se的分子构型是
(4)H2O的沸点高于H2Se的沸点(-42℃),其原因是
Ⅱ.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(5)C、N、O三种元素第一电离能从大到小的顺序是
(6)1molN2F2含有
您最近一年使用:0次
名校
解题方法
2 . 根据要求填空
(1)选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤CaBr2 ⑥NaH ⑦ K3C60 ⑧石墨 ⑨氯化铵 ⑩铜晶体 熔化时不破坏化学键的有_______ ;含有非极性共价键的有_______ 。
(2)性质比较:(填“>”、“=”或“<”,下同)
①第一电离能Mg_______ Al,解释原因_______
②酸性强弱HClO4_______ HClO3,解释原因_______
(3)下图为几种晶体或晶胞的示意图(用名称填写)
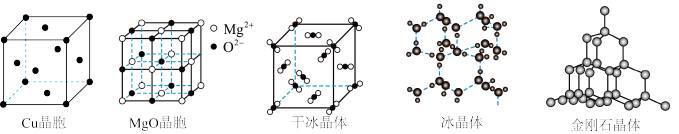
①上述晶体中,粒子之间以共价键结合形成的晶体是_______ 。
②冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为_______ 。
(1)选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤CaBr2 ⑥NaH ⑦ K3C60 ⑧石墨 ⑨氯化铵 ⑩铜晶体 熔化时不破坏化学键的有
(2)性质比较:(填“>”、“=”或“<”,下同)
①第一电离能Mg
②酸性强弱HClO4
(3)下图为几种晶体或晶胞的示意图(用名称填写)

①上述晶体中,粒子之间以共价键结合形成的晶体是
②冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为
您最近一年使用:0次
名校
3 . 某些共价键的键能数据如下表(单位:kJ·mol-1):
(1)把1molCl2分解为气态原子时,需要_______ (填“吸收”或“放出”)_______ kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是_______ ,最不稳定的是_______ ;形成的化合物分子中最稳定的是_______ 。
(3)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)的反应热_______ 。
(4)1919年,Langmuir提出等电子原理:原子总数相同、价电子总数相同的微粒,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,写出一种与 互为等电子体的分子
互为等电子体的分子_______ 。
(5)元素H、N、O第一电离能由小到大的顺序为_______
| 共价键 | H—H | Cl—Cl | Br—Br | H—Cl | H—I |
| 键能 | 436 | 243 | 193 | 432 | 298 |
| 共价键 | I—I | N≡N | H—O | H—N | |
| 键能 | 151 | 946 | 463 | 393 | |
(1)把1molCl2分解为气态原子时,需要
(2)由表中所列化学键形成的单质分子中,最稳定的是
(3)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)的反应热
(4)1919年,Langmuir提出等电子原理:原子总数相同、价电子总数相同的微粒,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,写出一种与
 互为等电子体的分子
互为等电子体的分子(5)元素H、N、O第一电离能由小到大的顺序为
您最近一年使用:0次
4 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
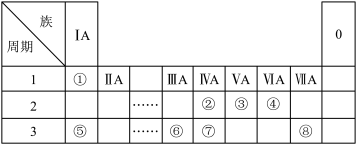
(1)上述八种元素中,最高价氧化物的水化物酸性最强的化合物是___________ (填化学式),③的基态原子核外电子的运动状态有___________ 种。
(2)④、⑤、⑥、⑧的简单离子半径由小到大的顺序是___________ (填离子符号)。②③④三种元素中第一电离能最大的是___________ (填元素符号)
(3)单质④有两种同素异形体,其中沸点高的是___________ (填化学式),原因是___________ ;④和⑤的氢化物所属的晶体类型分别为___________ 和___________ 。

(1)上述八种元素中,最高价氧化物的水化物酸性最强的化合物是
(2)④、⑤、⑥、⑧的简单离子半径由小到大的顺序是
(3)单质④有两种同素异形体,其中沸点高的是
您最近一年使用:0次
解题方法
5 . 磷化硼(BP)是一种受到高度关注的金属保护层耐磨材料,可由三溴化硼和三溴化磷在氢气中高温制得。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为____ ,核外电子数最多的元素的基态原子电子占据最高能级上的电子数为____ 。B所在的周期第一电离能最大的元素名称为____ 。
(2)三溴化磷分子的中心原子价层电子对数为____ ,分子空间结构为____ 形。BBr3空间结构为____ 形,PBr3分子中键角比BBr3分子中键角____ (填>、<或=)。
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJ•mol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJ•mol-1,这种固体高聚氮可能潜在的用途是____ ,这是因为____ 。
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为____ ,已知晶胞参数a=478pm,则硼和磷原子的核间距为____ pm(保留整数)。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为
(2)三溴化磷分子的中心原子价层电子对数为
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJ•mol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJ•mol-1,这种固体高聚氮可能潜在的用途是
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为
您最近一年使用:0次
名校
6 . 向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____ 区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____ 。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____ (用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____ (用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____ 杂化;SO42-离子的立体构型是____ ,写出与SO42-互为等电子体的一种离子____ 。
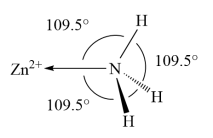
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____ 。
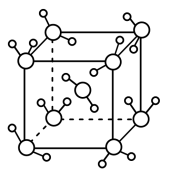
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为____ g.cm-3(只列式,不计算)。
(1)铜元素位于元素周期表中
(2)非金属元素N、O、S的第一电离能由大到小的顺序是
(3)上述深蓝色晶体中含有的元素的电负性最小的是
(4)H2O的中心原子轨道杂化类型为
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因

(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为

您最近一年使用:0次
2019-11-13更新
|
289次组卷
|
3卷引用:2019年四川省遂宁市高三零诊考试理综化学试题
7 . 五种元素的原子电子层结构如下:A.1s22s1;B.1s22s22p4;C.1s22s22p6;D.1s22s22p63s23p2;E.[Ar]3d104s1。(用元素符号作答)
(1)元素的第一电离能最大的是______________ ;
(2)属于过渡元素的是__________________ ;
(3)元素的电负性最大的是________________ ;
(4)上述元素之间能形成X2Y型化合物的化学式是__________ 、___________ 。
(1)元素的第一电离能最大的是
(2)属于过渡元素的是
(3)元素的电负性最大的是
(4)上述元素之间能形成X2Y型化合物的化学式是
您最近一年使用:0次
2016-12-08更新
|
406次组卷
|
4卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
(已下线)2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷(已下线)2011-2012学年山西大同实验中学高二下学期期中考试化学试卷辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷



