名校
解题方法
1 . 根据物质结构的有关性质和特点,回答下列问题:
(1)基态氧原子的价电子排布图为___________ ,基态镁原子核外有种能量不同的电子,Cr3+基态核外电子排布式为___________ 。
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是___________ ,H、C、N元素电负性由大到小的顺序为___________ 。
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为___________ ,碳、氮、氧、氟元素的第三电离能从小到大的顺序为___________ 。
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的___________ 区,Sm3+价层电子排布式为___________ 。
(5)雌黄的分子式为As2S3,其分子结构为 ,As原子的杂化类型为
,As原子的杂化类型为___________ 。
(6)LiBH4由Li+和BH 构成,BH
构成,BH 的立体构型是
的立体构型是___________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为___________ 。
(1)基态氧原子的价电子排布图为
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的
(5)雌黄的分子式为As2S3,其分子结构为
 ,As原子的杂化类型为
,As原子的杂化类型为(6)LiBH4由Li+和BH
 构成,BH
构成,BH 的立体构型是
的立体构型是
您最近一年使用:0次
名校
2 . 按要求回答下列问题:
(1)研究发现,在 低压合成甲醇反应(
低压合成甲醇反应( )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第_______ 号元素。元素Mn与O中,基态原子核外未成对电子数较多的是_______ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐 。
。
①氮原子的价电子排布式为_______ 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。

其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是_______ ;氮元素的 呈现异常的原因是
呈现异常的原因是_______ 。
(3)已知As元素的相关信息如图所示,下列说法不正确的是_______。

(1)研究发现,在
 低压合成甲醇反应(
低压合成甲醇反应( )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第(2)我国科学家成功合成了世界上首个五氮阴离子盐
 。
。①氮原子的价电子排布式为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能
 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。
其中除氮元素外,其他元素的
 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是(3)已知As元素的相关信息如图所示,下列说法不正确的是_______。

| A.推测As能形成多种氧化物 |
B.热稳定性: 逐渐减弱 逐渐减弱 |
C.As的一种核素表示为 ,中子数为40 ,中子数为40 |
| D.原子半径由大到小的顺序:As、Cl、Si |
您最近一年使用:0次
3 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
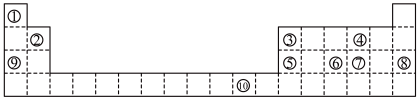
请回答下列问题:
(1)表中元素⑩的二价离子的外围电子排布图为:___________ ,该元素属于___________ 区元素。
(2)基态原子⑦核外电子总共有___________ 种能量,电子占据的能量最高的能级符号为___________
(3)在标号的主族元素中,第一电离能最小的是___________ (填元素符号,下同),电负性最大的是___________
(4)写出由①④⑨三种元素组成的化合物的电子式___________ ,将该化合物溶于水,破坏的作用力有___________ ;
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与 溶液反应的化学方程式:
溶液反应的化学方程式:___________

请回答下列问题:
(1)表中元素⑩的二价离子的外围电子排布图为:
(2)基态原子⑦核外电子总共有
(3)在标号的主族元素中,第一电离能最小的是
(4)写出由①④⑨三种元素组成的化合物的电子式
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与
 溶液反应的化学方程式:
溶液反应的化学方程式:
您最近一年使用:0次
2021-11-13更新
|
540次组卷
|
3卷引用:四川省绵阳南山中学2021-2022学年高二上学期半期考试化学试题
四川省绵阳南山中学2021-2022学年高二上学期半期考试化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题
名校
4 . 完成下列各题:
(1)写出电子式NH4Cl_______ ,它的阳离子价层电子对对数为______ ,该离子空间构型为_______ 。
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________ ,它的基态原子结构示意图为_____ ,A+离子的价层电子排布图为____________ ,A2+离子的价层电子排布式为_____________ ,A+离子和A2+离子较稳定的是(填离子符号)_______ ,原因________________________ 。
(3)乙炔和乙烯分子,它们的σ键个数之比为______ ,乙烯分子中C原子杂化方式为________ ,C、N、O三种原子第一电离能从大到小排列____________ 。
(1)写出电子式NH4Cl
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为
(3)乙炔和乙烯分子,它们的σ键个数之比为
您最近一年使用:0次
名校
解题方法
5 . 翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)基态Cr原子的电子排布式为_______ ;Fe位于元素周期表的____ 区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为________ ,其中四种元素第一电离能由小到大的顺序是________ 。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?________ 。
(4)在硅酸盐中存在 结构单元,其中Si原子的杂化轨道类型为
结构单元,其中Si原子的杂化轨道类型为________ 。当无限多个(用n表示) 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为
形成层状结构时(如图所示),其中Si、O原子的数目之比为________ 。若其中有一半的Si被Al替换,其化学式为________ 。

(5)Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为________ ,若Ca与O的核间距离为x nm,则该晶体的密度为_______ g/cm3。

(1)基态Cr原子的电子排布式为
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?
(4)在硅酸盐中存在
 结构单元,其中Si原子的杂化轨道类型为
结构单元,其中Si原子的杂化轨道类型为 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为
形成层状结构时(如图所示),其中Si、O原子的数目之比为
(5)Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为

您最近一年使用:0次
2018-04-25更新
|
345次组卷
|
2卷引用:【全国市级联考】四川省绵阳市2018届高三第三次诊断性考试理综化学试题



