1 . 磷酸亚铁锂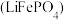 和锰酸锂
和锰酸锂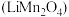 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:
(1)基态O原子的价电子轨道表示式为___________ ;Mn的原子结构示意图为___________ 。
(2) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) 。
。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性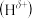 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性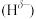 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是___________ 。
(4)已知: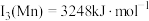 ,
,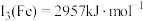 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过螯合作用 形成的配位键有___________ mol。
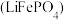 和锰酸锂
和锰酸锂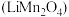 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:(1)基态O原子的价电子轨道表示式为
(2)
 的熔、沸点
的熔、沸点 。
。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性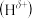 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性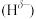 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是(4)已知:
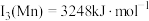 ,
,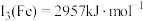 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过
您最近一年使用:0次
2023高三·全国·专题练习
2 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为_______ 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。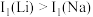 ,原因是
,原因是_______ 。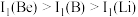 ,原因是
,原因是_______ 。
(1)基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。
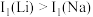 ,原因是
,原因是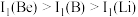 ,原因是
,原因是 | ||
 520 |  900 | B 801 |
 496 |  738 |  578 |
您最近一年使用:0次
解题方法
3 . 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。请回答以下问题:
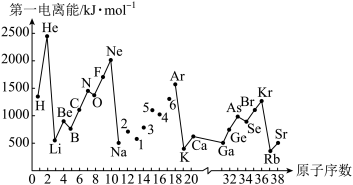
(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象____ 。
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律____ 。
(3)图中5号元素在周期表中的位置是____ 、电子排布____ 。
(4)图中N元素比O元素第一电离能高的原因是____ 。
(5)C、H元素形成的化合物分子中共有14个电子,该分子中____ 个σ键,____ 个π键,中心原子杂化模式____ ,分子空间构型____ 。

(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律
(3)图中5号元素在周期表中的位置是
(4)图中N元素比O元素第一电离能高的原因是
(5)C、H元素形成的化合物分子中共有14个电子,该分子中
您最近一年使用:0次
名校
解题方法
4 . 磷酸铁锂 电极材料主要用于各种锂离子电池,回到下列问题
电极材料主要用于各种锂离子电池,回到下列问题
(1) 位于元素周期表中第
位于元素周期表中第_______ 周期_______ 族,其价电子排布式为_______ 。
(2)用“>”、“<”成“=”填空:离子半径:
_______  ;第一电离能:
;第一电离能:
_______  ;电负性:O
;电负性:O_______ P。
(3)在周期表中,化学性质最相似的邻族元素是_______ 。
(4)下列 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
(5)基态P中未成对的电子数为_______ ,其原子核外电子占据的最高能级的电子云轮廓为_______ 形。
(6) 与
与 两元素的部分电离能数据如下,由表中两元素的
两元素的部分电离能数据如下,由表中两元素的 和
和 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是_______ 。
 电极材料主要用于各种锂离子电池,回到下列问题
电极材料主要用于各种锂离子电池,回到下列问题(1)
 位于元素周期表中第
位于元素周期表中第(2)用“>”、“<”成“=”填空:离子半径:

 ;第一电离能:
;第一电离能:
 ;电负性:O
;电负性:O(3)在周期表中,化学性质最相似的邻族元素是
(4)下列
 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。A. | B.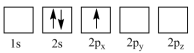 |
C. | D. |
(6)
 与
与 两元素的部分电离能数据如下,由表中两元素的
两元素的部分电离能数据如下,由表中两元素的 和
和 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是| 元素 |  |  | |
电离能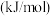 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 |
您最近一年使用:0次
2022-01-22更新
|
580次组卷
|
3卷引用:四川省凉山州宁南中学2022-2023学年高二下学期第一次月考化学试题
5 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
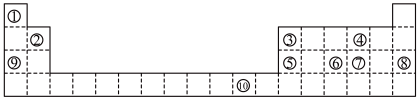
请回答下列问题:
(1)表中元素⑩的二价离子的外围电子排布图为:___________ ,该元素属于___________ 区元素。
(2)基态原子⑦核外电子总共有___________ 种能量,电子占据的能量最高的能级符号为___________
(3)在标号的主族元素中,第一电离能最小的是___________ (填元素符号,下同),电负性最大的是___________
(4)写出由①④⑨三种元素组成的化合物的电子式___________ ,将该化合物溶于水,破坏的作用力有___________ ;
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与 溶液反应的化学方程式:
溶液反应的化学方程式:___________

请回答下列问题:
(1)表中元素⑩的二价离子的外围电子排布图为:
(2)基态原子⑦核外电子总共有
(3)在标号的主族元素中,第一电离能最小的是
(4)写出由①④⑨三种元素组成的化合物的电子式
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与
 溶液反应的化学方程式:
溶液反应的化学方程式:
您最近一年使用:0次
2021-11-13更新
|
540次组卷
|
3卷引用:四川省绵阳南山中学2021-2022学年高二上学期半期考试化学试题
四川省绵阳南山中学2021-2022学年高二上学期半期考试化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
6 . 已知A、B、C、D都是短周期元素,它们的原子半径大小顺序为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在___________ 个未成对电子。
(2)基态E2+的核外电子排布式为___________ 。
(3)基态D原子的最高能层的电子排布图为___________
(4)M分子中B原子轨道的杂化类型为___________ 。
(5)B、C、D三种元素的第一电离能由小到大的顺序为___________ 。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在
(2)基态E2+的核外电子排布式为
(3)基态D原子的最高能层的电子排布图为
(4)M分子中B原子轨道的杂化类型为
(5)B、C、D三种元素的第一电离能由小到大的顺序为
您最近一年使用:0次
2021-10-26更新
|
290次组卷
|
5卷引用:四川省巴中市恩阳区2022-2023学年高二下学期4月期中考试化学试题
7 . 中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为___________ 。除K、S外第一电离能从大到小的顺序为___________ 。N2 与CO2熔沸点高低顺序为___________ 。
②在生成物中,A的晶体类型为___________ ,含极性共价键的分子的中心原子轨道杂化类型为___________ 。
③CN﹣与N2互为___________ ,推算HCN分子中σ键与π键数目之比___________ 。
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的晶体类型为
③CN﹣与N2互为
您最近一年使用:0次
名校
解题方法
8 . (1) 26Fe的简化电子排布式___________ 按电子排布式它属于___________ 区
(2)C、 N、O三种元素的第一电离能有大到小的排序为___________
(3)价电子排布式为3d54s2的原子,其原子结构示意图为___________
(4)指出配合物K3[Co(CN)6]中的配体___________
(5)判断BF3分子的立体构型、中心原子成键时采取的杂化轨道类型___________ 、___________
(2)C、 N、O三种元素的第一电离能有大到小的排序为
(3)价电子排布式为3d54s2的原子,其原子结构示意图为
(4)指出配合物K3[Co(CN)6]中的配体
(5)判断BF3分子的立体构型、中心原子成键时采取的杂化轨道类型
您最近一年使用:0次
9 . 下图是元素周期表的简略框架图。

(1)请在上图所示的元素周期表中画出金属元素与非金属元素的分界线__ 。元素周期表的5个区中,不全是金属元素的区为__ 。
(2)根据氢元素最高正化合价与最低负化合价的绝对值相等,你认为还可把氢元素放在元素周期表中的_____ 族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实:____ 。
(3)上图中元素①②的原子价电子排布式分别为___ 、____ 。比较元素①与元素②的下列性质(填“>”或“<”)。原子半径:①_____ ②;电负性:①____ ②;金属性:①_____ ②;第一电离能:①_____ ②。
(4)某短周期元素最高正化合价为+7,其电子排布式为____

(1)请在上图所示的元素周期表中画出金属元素与非金属元素的分界线
(2)根据氢元素最高正化合价与最低负化合价的绝对值相等,你认为还可把氢元素放在元素周期表中的
(3)上图中元素①②的原子价电子排布式分别为
(4)某短周期元素最高正化合价为+7,其电子排布式为
您最近一年使用:0次
10 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:
(1)写出下列元素的符号:B_____ 、C_____ 。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是____ ,电负性最大的元素是____ 。
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在____ 区。
(4)写出A的核外电子排布式_____ 。
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的价电子排布式3d64s2。回答下列问题:(1)写出下列元素的符号:B
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在
(4)写出A的核外电子排布式
您最近一年使用:0次
2020-10-24更新
|
287次组卷
|
3卷引用:四川省平昌县驷马中学2020-2021学年高二上学期10月月考化学试题
四川省平昌县驷马中学2020-2021学年高二上学期10月月考化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题(已下线)第01章 原子结构与元素性质(B卷能力提升篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)



