1 . 填写下列空白[第(1)~(3)小题用元素符号填写]。
(1)第三周期原子半径最小的元素___________ ;
(2)电负性最大的元素___________ ;
(3)第四周期中第一电离能最小的元素___________ ;
(4)最外层电子排布为4s24p1的原子的核电荷数为___________ ;
(5)周期表中最活泼的非金属元素原子的轨道表示式为___________ ;
(6)某元素核外有三个电子层,最外层电子数是核外电子总数的 ,写出该元素的离子结构示意图
,写出该元素的离子结构示意图___________ ;
(1)第三周期原子半径最小的元素
(2)电负性最大的元素
(3)第四周期中第一电离能最小的元素
(4)最外层电子排布为4s24p1的原子的核电荷数为
(5)周期表中最活泼的非金属元素原子的轨道表示式为
(6)某元素核外有三个电子层,最外层电子数是核外电子总数的
 ,写出该元素的离子结构示意图
,写出该元素的离子结构示意图
您最近一年使用:0次
2 . 现有四种元素基态原子的电子排布式如下:①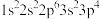 ②
②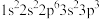 ③
③ ④
④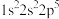 。则下列有关比较中正确的是
。则下列有关比较中正确的是
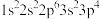 ②
②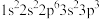 ③
③ ④
④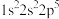 。则下列有关比较中正确的是
。则下列有关比较中正确的是| A.第一电离能:④>③>②>① |
| B.电负性:④>③>①>② |
| C.原子半径:④>③>②>① |
| D.最高正化合价:④>③=②>① |
您最近一年使用:0次
名校
3 . 由四种短周期主族元素形成的某有机物甲的结构如图所示,X、Y、Z、W的原子序数依次增大,Y、Z、W、X的原子半径依次减小。下列说法错误的是


| A.通常状况下,由于甲分子间形成氢键使甲呈固态 |
B.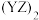 为直线形分子,分子中存在极性键和非极性键 为直线形分子,分子中存在极性键和非极性键 |
C.甲分子中Z的杂化方式为 |
| D.简单离子半径Z>W,第一电离能Y>Z>W |
您最近一年使用:0次
名校
4 . 我国学者首次发现非水相氮还原过程中的多米诺效应。如图甲所示,一旦完成反应①,反应②③将自发完成。

(1)氮原子比氧原子的第一电离能___________ (填“大”或“小”),原因是___________ 。
(2) 中氮原子采取
中氮原子采取___________ 杂化方式。 能以配位键与铜离子形成
能以配位键与铜离子形成 ,写出其中心离子的核外电子排布式:
,写出其中心离子的核外电子排布式:___________ ;形成配位键后氨分子中的键角___________ (填“变大”或“变小”)。
(3)写出与氮气互为等电子体的一种阴离子:___________ 。
(4)反应③中,断裂的是___________ (填序号,下同),形成的是___________ 。
A.配位键 B.极性键
C.离子键 D.氢键
(5)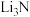 的熔、沸点比
的熔、沸点比 的
的___________ (填“高”或“低”),试解释原因:___________ 。
(6)锂离子还原是锂介质氮还原反应的关键步骤,研究者发现金纳米颗粒可充当锂离子还原的电催化材料。金属金的堆积方式如图乙所示:

①结合图丙计算金属金晶胞中原子数、四面体空隙数和八面体空隙数的最简比值为___________ 。

②若金原子半径为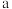 pm,相对原子质量用
pm,相对原子质量用 表示,则晶体密度的表达式为
表示,则晶体密度的表达式为___________  。
。

(1)氮原子比氧原子的第一电离能
(2)
 中氮原子采取
中氮原子采取 能以配位键与铜离子形成
能以配位键与铜离子形成 ,写出其中心离子的核外电子排布式:
,写出其中心离子的核外电子排布式:(3)写出与氮气互为等电子体的一种阴离子:
(4)反应③中,断裂的是
A.配位键 B.极性键
C.离子键 D.氢键
(5)
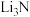 的熔、沸点比
的熔、沸点比 的
的(6)锂离子还原是锂介质氮还原反应的关键步骤,研究者发现金纳米颗粒可充当锂离子还原的电催化材料。金属金的堆积方式如图乙所示:

①结合图丙计算金属金晶胞中原子数、四面体空隙数和八面体空隙数的最简比值为

②若金原子半径为
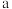 pm,相对原子质量用
pm,相对原子质量用 表示,则晶体密度的表达式为
表示,则晶体密度的表达式为 。
。
您最近一年使用:0次
名校
解题方法
5 . 表明TiO2-aNb、Cu(In1-xGaxSe2)是光学活性物质,具有非常好的发展前景。
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]_______ ;Ga、In、Se第一电离能从大到小顺序为_______ 。
(2)H2SeO3与 H2SO3中酸性更强的是_______ ;原因是_______ 。
(3)31Ga可以形成 GaCl3·xNH3(x=3、4、5、6) 等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2,则该溶液中溶质的化学式为_______ 。
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是_______ 。 向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:_______ 。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为a pm和b pm,阿伏加德罗常数的值为NA。
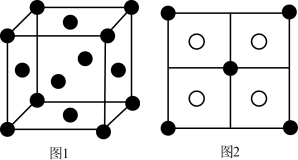
①CuS晶体中,相邻的两个铜离子间的距离为_______ pm。
②Cu2S晶体的密度为ρ=_______ g·cm-3(列出计算式即可)。
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]
(2)H2SeO3与 H2SO3中酸性更强的是
(3)31Ga可以形成 GaCl3·xNH3(x=3、4、5、6) 等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2,则该溶液中溶质的化学式为
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为a pm和b pm,阿伏加德罗常数的值为NA。

①CuS晶体中,相邻的两个铜离子间的距离为
②Cu2S晶体的密度为ρ=
您最近一年使用:0次
名校
解题方法
6 . 已知A、B、C、D、E、F是原子序数依次增大的短周期元素。其中A是周期表中原子半径最小的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E元素价层电子数为2;F与D的最高能层数相同,但其价层电子数等于其电子层数。下列说法正确的是
| A.电负性比较:B>C>A | B.第一电离能比较:F>E>D |
| C.简单离子半径比较:B>C>D | D.相应化合物熔点比较:D2C>EC>BA3>A2C |
您最近一年使用:0次
2022-05-18更新
|
185次组卷
|
3卷引用:湖南省株洲市茶陵县第一中学2021-2022学年高二下学期期中考试化学试题
名校
7 . F2、Ne、Ar、Kr(氪,第四周期)、Xe(氙,第五周期)是半导体行业光刻气的主要原料,其中F2和Xe在高温下可以化合生成XeF2。下列说法错误的是
| A.Xe的价电子排布为4d105s25p6 |
| B.氧化性:F2>XeF2 |
| C.Xe的原子序数比Kr大16 |
| D.第一电离能:Xe<Kr<Ar<Ne,F2与Kr化合更困难 |
您最近一年使用:0次
名校
8 . 前4周期主族元素X、Y、Z、W的原子序数依次增大。X与Z同主族,且基态X原子中p能级和s能级上的电子数相同。Y、Z同周期,Y位于IIIA族,W最外层有2个电子。下列说法正确的是
| A.原子半径:r(X)<r(Y)<r(Z)<r(W) |
| B.最高价氧化物对应水化物的碱性:W<Y |
| C.第一电离能:I1(Z)<I1(X) |
| D.基态W原子内层原子轨道均已充满电子 |
您最近一年使用:0次
2022-05-07更新
|
525次组卷
|
5卷引用:湖南省永州市第一中学2022届高三下学期期中考试考试化学试题
湖南省永州市第一中学2022届高三下学期期中考试考试化学试题江苏省南通泰州等七市2022届高三第三次调研测试化学试题江苏省响水中学2022-2023学年高二上学期10月学情分析考试化学试题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)宁夏石嘴山市平罗中学2023-2024学年高二上学期期中考试化学试题
9 . 人们认识世界的过程经历了从宏观到微观的过程,随着认识的不断深入,一个又一个的旧模型被打破,相应地一个又一个的新模型被建立起来。下列说法正确的是
| A.电子云是描述核外电子运动轨迹的,如s电子云是描述电子在一个特定半径的球内运动 |
| B.同一个原子中不存在两个运动状态完全一致的电子这一事实是受洪特规则限制 |
C.同一周期元素的 从左至右依次增大,同周期元素中电负性最大的元素是最右边的元素 从左至右依次增大,同周期元素中电负性最大的元素是最右边的元素 |
| D.电负性大小可以用于判断元素金属性和非金属性强弱 |
您最近一年使用:0次
2022-05-04更新
|
96次组卷
|
2卷引用:湖南省三湘名校教育联盟、五市十校教研教改共同体2021-2022学年高二下学期期中考试化学试题
名校
10 . 下图是11~17号元素的某种性质变化趋势柱形图,y轴表示的可能是
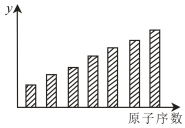
| A.第一电离能 | B.原子半径 |
| C.电负性 | D.形成基态离子转移的电子数目 |
您最近一年使用:0次
2022-05-01更新
|
283次组卷
|
12卷引用:湖南省邵东创新实验学校2021-2022学年高二下学期期中考试化学试题
湖南省邵东创新实验学校2021-2022学年高二下学期期中考试化学试题浙江金华第一中学2021-2022学年高一领军班下学期期中考试化学试题广东省珠海市第二中学2021-2022学年高二下学期期中考试化学试题广东省珠海市第四中学2021-2022学年高二下学期期中考试化学试题陕西省西安市雁塔区第二中学、渭北中学2021-2022学年高二下学期期中联考化学试题浙江省玉环市玉城中学2021-2022学年高二下学期第一次月考化学试题广东省湛江市第二中学2021-2022学年高二下学期第16周(6.4)周练化学试题广东省深圳市盐田高级中学2021-2022学年高二下学期4月考试化学试题广东省顺德区均安中学2021-2022学年高二选择性必修2阶段考试化学试题江苏无锡市第三高级中学2023-2024学年高二上学期期中考试化学试卷广东省佛山市顺德区罗定邦中学2022-2023学年高二下学期3月第一次月考化学试题广东省梅州市梅雁中学2023-2024学年高二下学期3月月考化学试题



