名校
解题方法
1 . 已知P4单质的结构如下,P4在KOH溶液中的变化是:P4+3KOH+3H2O=3KH2PO2+PH3下列说法正确的是
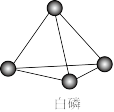
| A.产物PH3分子中所有的原子可能共平面 |
| B.31gP4含有1.5NA个P−P键 |
| C.相关元素的电负性大小顺序:P>O>H>K |
| D.P4中P原子为sp2杂化 |
您最近一年使用:0次
2020-08-21更新
|
287次组卷
|
8卷引用:天津市武清区杨村第一中学2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
2 . 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是( )
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐减小 |
| B.电负性:E>C |
| C.D、B、E三种元素形成的简单离子的半径逐渐增大 |
| D.气态氢化物的稳定性顺序:D>B>E |
您最近一年使用:0次
2020-06-09更新
|
342次组卷
|
9卷引用:天津市耀华中学2022-2023学年高二上学期期末考试化学试题
天津市耀华中学2022-2023学年高二上学期期末考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区四川省西充中学 2021-2022 学年高二上学期期中考试化学试题专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题2.2.2元素第一电离能和电负性的周期性变化 课后湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
解题方法
3 . 已知M、N两种元素分别位于s区、p区,下列说法中错误 的是
| A.基态时,N原子的最外电子层上的电子数一定比M原子的多 |
| B.N元素的电负性不一定比M元素的大 |
| C.由M、N两种元素所形成的化合物中,N一定显负价 |
| D.若M、N原子的电子层数相同,则原子半径:M > N |
您最近一年使用:0次
名校
4 . 如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
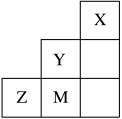

| A.电负性:Z>M>Y |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子轨道表示式为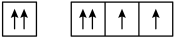 |
您最近一年使用:0次
2020-05-06更新
|
414次组卷
|
9卷引用:天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题
天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题四川省成都外国语学校2019-2020学年高二下学期开学考试化学试题四川省邛崃市高埂中学2019-2020学年度高二下学期期中考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】
名校
解题方法
5 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________ ,磷的基态原子的价电子排布式为__________ ,六种元素中电负性最大的是__________ (填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________ 。NH3的分子构型为__________ ,中心原子的杂化方式为__________ 。
(3)热稳定性:NH3_____ PH3(填“>”或“<”),沸点:N2H4______ P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________ 。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________ 。
(1)砷(As)在元素周期表中的位置为
(2)N2分子中σ键和π键的数目比N(σ): N(π)=
(3)热稳定性:NH3
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入
您最近一年使用:0次



