名校
1 . 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是
| A.N元素基态原子所有价电子的电子云轮廓图均为哑铃形 |
| B.Se元素基态原子的电子排布式为[Ar]4s24p4 |
| C.O、F、Cl电负性由大到小的顺序为F>Cl>O |
| D.第一电离能As>Se |
您最近一年使用:0次
2023-03-24更新
|
544次组卷
|
4卷引用:河北省2023届高三下学期高考前适应性考试化学试题
名校
解题方法
2 . 已知 号元素的离子
号元素的离子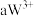 、
、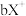 、
、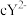 、
、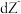 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是
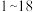 号元素的离子
号元素的离子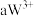 、
、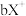 、
、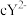 、
、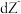 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是A.质子数: ,离子的还原性: ,离子的还原性: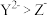 |
B.电负性: |
C.氢化物的稳定性: |
D.原子半径: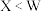 ,第一电离能: ,第一电离能: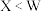 |
您最近一年使用:0次
2022-12-02更新
|
1077次组卷
|
34卷引用:2016-2017学年河北省衡水中学高二上学期五调考试化学试卷
2016-2017学年河北省衡水中学高二上学期五调考试化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1河北省石家庄市启明中学2019-2020学年高二四月月考化学试题2015-2016学年贵州省思南中学高二下第一次月考化学试卷2015-2016学年山西大学附属中学高二下3月月考化学试卷2015-2016学年吉林省汪清六中高二3月月考化学试卷2015-2016学年山西大学附中高二下3月月考化学试卷2016-2017学年河南省洛阳市第一高级中学高二(平行班)3月月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题贵州省思南中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题吉林省白山市第七中学2019-2020学年高二下学期3月份月考化学试题鲁科版(新)必修第二册第一章检测题辽宁省六校协作体2019-2020学年高二下学期期中考试化学试卷(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第3课时 元素的电负性及其变化规律鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第2课时 元素的电负性及其变化规律(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)专题强化练2 电离能和电负性的应用吉林省辉南县第六中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题北京市第三十五中学2021-2022学年高三上学期期中考试化学试题四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题内蒙古自治区赤峰第四中学2023-2024学年高二下学期4月月考化学试题
名校
3 . 短周期元素X、Y、Z、W、E原子核外电子数依次增多。X的原子半径是短周期元素中最小的;Y、Z、W位于同一周期,Z元素基态原子中p轨道所含电子数与s轨道相等;E与W同主族。它们组成的某种分子的结构式如图所示,下列说法正确的是
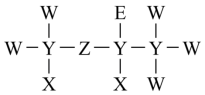
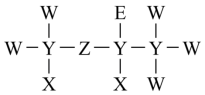
A.简单阴离子半径: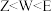 |
| B.同主族元素中E的最高价氧化物对应水化物的酸性最强 |
C.电负性: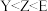 |
D.离子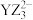 的中心原子的杂化方式是 的中心原子的杂化方式是 杂化 杂化 |
您最近一年使用:0次
2022-01-27更新
|
650次组卷
|
5卷引用:河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题
4 . “律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,它由Q、W、X、Y、Z五种原子序数依次增大的元素组成。该五种元素的性质或结构信息如下表:
下列说法正确的是
| 元素 | 信息 |
| Q | 基态原子只有一种形状的轨道填有电子,并容易形成共价键 |
| W | 基态原子有5个原子轨道填充有电子,有2个未成对电子 |
| X | 最高价氧化物对应的水化物与Y、Z最高价氧化物对应的水化物都能反应 |
| Y | 在元素周期表中位于第3周期、第ⅥA族 |
| Z | 焰色反应为紫色 |
| A.电负性:Q<W<Y | B.第一电离能:W<X<Z |
| C.简单离子半径:X<W<Z<Y | D.这种物质只含离子键 |
您最近一年使用:0次
2022-11-02更新
|
1058次组卷
|
6卷引用:河北省张家口市张北县第一中学2022-2023学年高二下学期4月月考化学试题
解题方法
5 . 中国第一辆火星车“祝融号”成功登陆火星,探测发现火星上存在大量橄榄石矿物( ),已知晶体硅的晶胞如图,下列说法错误的是
),已知晶体硅的晶胞如图,下列说法错误的是
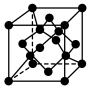
 ),已知晶体硅的晶胞如图,下列说法错误的是
),已知晶体硅的晶胞如图,下列说法错误的是
| A.Fe2+价电子排布式为3d6,未成对电子数是4 |
| B.橄榄石中各元素第一电离能和电负性大小顺序均为O>Si>Fe>Mg |
| C.硅的氯化物SiCl4分子是非极性分子,Si的杂化方式是sp3 |
D.若单晶硅晶胞参数是anm,则Si原子的原子半径为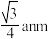 |
您最近一年使用:0次
2023-12-31更新
|
492次组卷
|
2卷引用:河北省2024届高三上学期大数据应用调研联合测评Ⅲ化学试卷
名校
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态Y原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物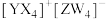 。下列叙述正确的是
。下列叙述正确的是
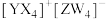 。下列叙述正确的是
。下列叙述正确的是A.氧化性: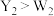 | B.电负性:Y>X>Z |
| C.Y的含氧酸一定是强酸 | D.第一电离能:Y<W |
您最近一年使用:0次
2023-12-30更新
|
480次组卷
|
2卷引用:河北省衡水市武强中学2023-2024学年高二上学期期末考试化学试题
名校
7 . 有关周期表和周期律的说法正确的是
| A.周期表p区所有元素,电子最后填入的能级均为p能级 |
| B.第二周期元素,电离能介于B和N之间的元素有1种 |
| C.周期表第14列元素形成化合物种类最多 |
| D.同一周期,第ⅡA族元素电负性大于第ⅢA族元素 |
您最近一年使用:0次
2023-02-11更新
|
716次组卷
|
9卷引用:河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题
河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题山东省济宁市2022-2023学年高二上学期期末考试化学试题山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题广东番禺中学2022-2023学年高二下学期4月期中考试化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷湖北省荆州市沙市中学2022-2023学年高二下学期2月月考化学试题
8 . 中国科学家在国际上首次实现了CO2到淀粉的合成,不依赖植物光合作用,原料只需CO2、H2和电,相关成果发表在《科学》上。回答下列问题:
(1)CO2的空间结构为_______ 。
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(3)淀粉在一定条件下可水解成葡萄糖(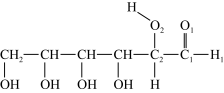 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1_______ ∠C1C2O2 (填“>”、“<”或“=”)。
(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。
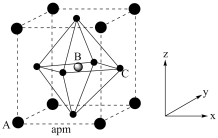
①Pb位于第六周期第IVA族,其基态原子的价电子排布图为_______ ,基态I原子核外电子占据最高能级的电子云轮廓图为_______ 。
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为_______ (用元素符号表示)。
③有机阳离子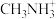 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是_______ 、_______ 。
④_______ (填“A”或“C”)代表I-,原子分数坐标A为(0,0,0),B为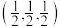 ,则C的原子分数坐标为
,则C的原子分数坐标为_______ 。NA为阿伏加德罗常数的值,则(CH3NH3)PbI3晶体的密度为_______ g∙cm-3。
(1)CO2的空间结构为
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(3)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。

①Pb位于第六周期第IVA族,其基态原子的价电子排布图为
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为
③有机阳离子
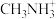 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是④
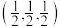 ,则C的原子分数坐标为
,则C的原子分数坐标为
您最近一年使用:0次
名校
9 . 卤素钙钛矿已经被广泛应用于太阳能电池、发光二极体等领域,其中合成二维/三维(2D/3D)的钙钛矿异质结是提升器件稳定性和转换效率的一个策略,近期化学工作者在气相合成的单晶三维钙钛矿CsPbBr3上合成外延生长的水平和垂直的二维钙钛矿(PEA)2PbBr4(PEA+代表 )异质结。回答下列问题:
)异质结。回答下列问题:
(1)基态Br原子的价电子排布式为___ 。
(2)PEA+中N的价层电子对数为___ ,杂化轨道类型为___ ,PEA+中涉及元素的电负性由大到小的顺序为___ ,1molPEA+中存在___ molσ键。
(3)已知铅卤化合物中存在正四面体构型的[PbCl4]2-、[PbBr4]2-、[PbI4]2-,三者中半径最小的配体为___ 。已知[Pb2I6]2-中每个Pb均采用四配位模式,则[Pb2I6]2-的结构式为___ 。
(4)Br2和碱金属单质形成的MBr熔点如表:
等量NaBr、KBr、RbBr、CsBr同时开始加热优先导电的是____ (填化学式),熔点呈现表中趋势的原因是____ 。
(5)已知三维立方钙钛矿CsPbBr3中三种离子在晶胞(a)中占据正方体顶点、面心、体心位置,图(b)显示的是三种离子在xz面、yz面、xy面上的位置:

若晶胞边长为apm,阿伏加德罗常数的值为NA,晶体的密度为___ g·cm-3 (写出表达式)。
②上述晶胞沿体对角线方向的投影图为___ (填标号)。
A. B.
B. C.
C. D.
D.
 )异质结。回答下列问题:
)异质结。回答下列问题:(1)基态Br原子的价电子排布式为
(2)PEA+中N的价层电子对数为
(3)已知铅卤化合物中存在正四面体构型的[PbCl4]2-、[PbBr4]2-、[PbI4]2-,三者中半径最小的配体为
(4)Br2和碱金属单质形成的MBr熔点如表:
| MBr | NaBr | KBr | RbBr | CsBr |
| 熔点/℃ | 747 | 734 | 693 | 636 |
等量NaBr、KBr、RbBr、CsBr同时开始加热优先导电的是
(5)已知三维立方钙钛矿CsPbBr3中三种离子在晶胞(a)中占据正方体顶点、面心、体心位置,图(b)显示的是三种离子在xz面、yz面、xy面上的位置:

若晶胞边长为apm,阿伏加德罗常数的值为NA,晶体的密度为
②上述晶胞沿体对角线方向的投影图为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2021-09-10更新
|
1548次组卷
|
4卷引用:河北省省级联测2021-2022学年高三上学期第一次考试化学试题
河北省省级联测2021-2022学年高三上学期第一次考试化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-讲义四川省遂宁市射洪中学校2021-2022学年高二下学期期中考试化学试题第三章 晶体结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
名校
解题方法
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Z处于同一主族,Y是短周期中电负性最大的元素,Z是同周期基态原子中未成对电子数最多的元素,W的族序数是周期序数的2倍。下列有关说法正确的是
| A.元素Z在周期表中位于第3周期VA族 |
| B.原子半径:r(X)<r(Y) |
| C.Z的第一电离能比W的小. |
| D.X的简单气态氢化物的热稳定性比Z的弱 |
您最近一年使用:0次
2022-04-02更新
|
587次组卷
|
2卷引用:河北省唐山市第一中学2022-2023学年高三上学期12月月考化学试题



