1 . 原子是肉眼和一般仪器都看不到的微粒,科学家们是根据可观察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1)下列说法中正确的个数是__________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式: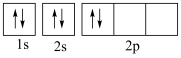
⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示 的形成过程:
的形成过程: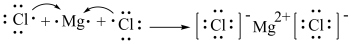
⑧基态钒原子的结构示意图为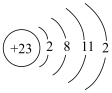
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__________ 、__________ 。
A.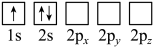 B.
B.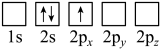
C.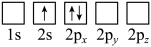 D.
D.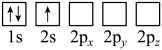
(3)研究发现,正离子的颜色与未成对电子数有关,例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是__________ (从微粒结构的角度进行描述)。
(4)钠在火焰上灼烧产生的黄光是一种原子__________ 光谱(选填“发射”或“吸收”)。
(5)第四周期的元素形成的化合物在生产生活中有着重要的用途。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为__________ ,按照电子排布式,镍元素在周期表中位于__________ 区。
②“玉兔二号”月球车通过砷化镓 太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为__________ 形。砷的电负性比镓__________ (填“大”或“小”)。
(6)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
①预测x值的区间:______ ~______ 。
②表中五种元素的第一电离能由大到小的顺序是__________ (写元素符号)。
(1)下列说法中正确的个数是__________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式:

⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示
 的形成过程:
的形成过程:
⑧基态钒原子的结构示意图为

| A.2 | B.3 | C.4 | D.5 |
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(3)研究发现,正离子的颜色与未成对电子数有关,例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是(4)钠在火焰上灼烧产生的黄光是一种原子
(5)第四周期的元素形成的化合物在生产生活中有着重要的用途。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
②“玉兔二号”月球车通过砷化镓
 太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为(6)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
元素编号 | a | b | c | d | e |
电负性 | 3.0 | 2.5 | x | 1.5 | 0.9 |
主要化合价 |
|
|
|
|
|
②表中五种元素的第一电离能由大到小的顺序是
您最近一年使用:0次
2024-03-08更新
|
274次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高二上学期1月期末考试化学试题
解题方法
2 . 第四周期中的18种元素具有重要的用途。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为_______ 。
(2)第四周期 族的元素中,电负性由大到小的顺序为(用元素符号表示)
族的元素中,电负性由大到小的顺序为(用元素符号表示)_______ 。
(3)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则 晶体类型为
晶体类型为_______ ,中心原子的杂化类型为_______ 。
(4) 的结构如图所示。
的结构如图所示。
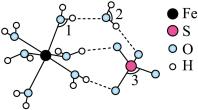
 中
中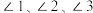 由大到小的顺序是
由大到小的顺序是_______ 。(用“1”“2”“3”表示)
(5)普鲁士蓝晶体属立方晶系,晶胞棱长为 。铁氰骨架组成晶胞中的8个小立方体,
。铁氰骨架组成晶胞中的8个小立方体, 粒子在小立方体顶点,
粒子在小立方体顶点, 在小立方体的棱上,两端均与
在小立方体的棱上,两端均与 相连,小立方体中心空隙可容纳
相连,小立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)
在图中省略)
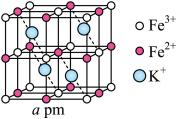
①普鲁士蓝中 与
与 个数之比为
个数之比为_______ ;
②若所有铁粒子为等径小球,则 与
与 之间最近距离为
之间最近距离为_______  。
。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为
(2)第四周期
 族的元素中,电负性由大到小的顺序为(用元素符号表示)
族的元素中,电负性由大到小的顺序为(用元素符号表示)(3)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则
 晶体类型为
晶体类型为(4)
 的结构如图所示。
的结构如图所示。
 中
中 由大到小的顺序是
由大到小的顺序是(5)普鲁士蓝晶体属立方晶系,晶胞棱长为
 。铁氰骨架组成晶胞中的8个小立方体,
。铁氰骨架组成晶胞中的8个小立方体, 粒子在小立方体顶点,
粒子在小立方体顶点, 在小立方体的棱上,两端均与
在小立方体的棱上,两端均与 相连,小立方体中心空隙可容纳
相连,小立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)
在图中省略)
①普鲁士蓝中
 与
与 个数之比为
个数之比为②若所有铁粒子为等径小球,则
 与
与 之间最近距离为
之间最近距离为 。
。
您最近一年使用:0次
解题方法
3 . Fe为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)甘氨酸亚铁络合物[ ]是一种新型的铁营养强化剂。
]是一种新型的铁营养强化剂。
① 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为___________ 。
②甘氨酸( )的沸点比相近相对分子质量的烷烃高很多,原因是
)的沸点比相近相对分子质量的烷烃高很多,原因是___________ 。
II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
(2)基态Ga原子的核外电子排布式为[Ar]___________ 。
(3)根据元素周期律,元素的电负性Ga___________ (填“大于”或“小于”)As。
(4)杀虫剂Na3AsO4中As原子采取___________ 杂化。
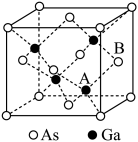
(5)共价晶体GaAs的晶胞参数a=xpm,它的晶胞结构如图所示,该晶体的密度为___________ (列出计算式,阿伏加德罗常数的值用NA表示) 。
。
(1)甘氨酸亚铁络合物[
 ]是一种新型的铁营养强化剂。
]是一种新型的铁营养强化剂。①
 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为②甘氨酸(
 )的沸点比相近相对分子质量的烷烃高很多,原因是
)的沸点比相近相对分子质量的烷烃高很多,原因是II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
(2)基态Ga原子的核外电子排布式为[Ar]
(3)根据元素周期律,元素的电负性Ga
(4)杀虫剂Na3AsO4中As原子采取
(5)共价晶体GaAs的晶胞参数a=xpm,它的晶胞结构如图所示,该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
4 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为___________ ,O、N、C、H四种元素电负性最大的是___________ (填元素符号) 。
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为___________ ,CH2=CHCH2CN分子中σ键与π键的数目比n(σ)∶n(π)=___________ 。
(3)用邻二氮菲(phen,如图 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有___________ (填序号)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因___________ 。
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
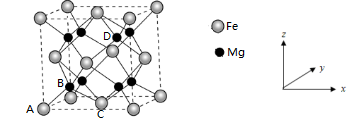
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ),C为(
),C为(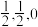 ),则D点坐标参数为
),则D点坐标参数为___________ 。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(3)用邻二氮菲(phen,如图
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ),C为(
),C为(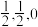 ),则D点坐标参数为
),则D点坐标参数为
您最近一年使用:0次
2021-01-29更新
|
299次组卷
|
2卷引用:山东省烟台市2020-2021学年高二上学期期末考试化学试题
名校
解题方法
5 . 铜及其化合物在生产生活中用途广泛。回答下列问题:
(1)目前,低压甲醇铜基催化剂的主要组分是CuO、ZnO和Al2O3,下列氧原子电子排布图表示的状态中,能量最高的是__ (填序号)。
A. B.
B.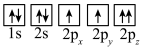
C. D.
D.
(2)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。
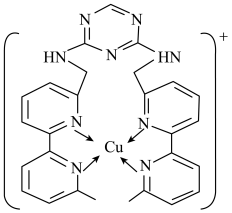
①该离子中含有化学键的类型有___ (填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
②H、N、Cu三种元素的电负性由大到小的顺序是___ 。H、N、Cu三种元素形成单质其熔点由低到高顺序为___ 。
(3)某磷青铜晶胞结构如图所示:
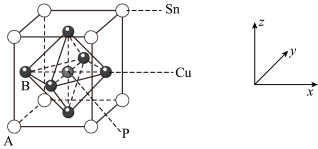
①其中原子坐标参数A为(0,0,0);B为(0, ,
, )。则P原子的坐标参数为
)。则P原子的坐标参数为___ 。
②该晶体中距离Cu原子最近的Sn原子有__ 个,这些Sn原子所呈现的构型为___ 。
(1)目前,低压甲醇铜基催化剂的主要组分是CuO、ZnO和Al2O3,下列氧原子电子排布图表示的状态中,能量最高的是
A.
 B.
B.
C.
 D.
D.
(2)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。

①该离子中含有化学键的类型有
A.极性键 B.离子键 C.非极性键 D.配位键
②H、N、Cu三种元素的电负性由大到小的顺序是
(3)某磷青铜晶胞结构如图所示:

①其中原子坐标参数A为(0,0,0);B为(0,
 ,
, )。则P原子的坐标参数为
)。则P原子的坐标参数为②该晶体中距离Cu原子最近的Sn原子有
您最近一年使用:0次

 ,
,
 ,
,
 ,
,




