1 . 下列有关物质性质说法中,正确的是
| A.s-sσ键与s-p σ键的电子云形状相同 |
| B.热稳定性:HF>HI>HBr>HCl |
| C.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① |
| D.某元素气态基态原子的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+,其最高正价为+5价 |
您最近一年使用:0次
2 . C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第_______ 周期第_______ 族,其基态原子的轨道表示式为_______ 。
(2)Cu的基态原子的电子排布式为_______ 。
(3)原子半径:Al_______ Si,电负性:N_______ O,第一电离能:C_______ N。(用“>”或“<”填空)
(4)Ge元素的最外层基态电子排布为4s24p2,Ge元素可能的性质或应用有_______。
(1)Si位于元素周期表第
(2)Cu的基态原子的电子排布式为
(3)原子半径:Al
(4)Ge元素的最外层基态电子排布为4s24p2,Ge元素可能的性质或应用有_______。
| A.是一种活泼的金属元素 | B.其电负性大于硅 |
| C.其单质可作为半导体材料 | D.其第一电离能小于硅 |
您最近一年使用:0次
解题方法
3 . 1932年美国化学家鲍林首先提出了电负性(用x表示)的概念。表中是某些短周期元素的x值:
(1)表格元素中,第一电离能最小的元素的基态原子电子排布式为____ 。
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。____
(3)第一电离能大小:Mg____ Al(填“大于”“小于”)。
(4)S元素和Cl元素基态原子核外未成对电子数之比为____ 。
(5)某有机化合物结构中含S-N键,其共用电子对偏向____ (写原子名称)。
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是____ 。
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。
(3)第一电离能大小:Mg
(4)S元素和Cl元素基态原子核外未成对电子数之比为
(5)某有机化合物结构中含S-N键,其共用电子对偏向
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是
您最近一年使用:0次
名校
解题方法
4 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为 ,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为 ,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是| A.与W生成的气态化合物的热稳定性:Z>Y |
B.W与 的原子半径:W<Li 的原子半径:W<Li |
| C.X和Y的第一电离能:X>Y |
D.X、Z、R的电负性: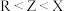 |
您最近一年使用:0次
2022-03-19更新
|
761次组卷
|
10卷引用:山东省泰安市2020-2021学年高二上学期期末考试化学试题
山东省泰安市2020-2021学年高二上学期期末考试化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)陕西省咸阳市实验中学2021-2022学年高二上学期第一次月考化学试题辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题 山东省菏泽第一中学2022-2023学年高二上学期期末考试化学试题(已下线)化学-2022年高考押题预测卷01(江苏卷)第一章原子结构与性质(基础卷)江西省宜春市宜丰中学2023-2024学年高二上学期12月月考化学试题广东省江门市广雅中学2023-2024学年高二下学期3月月考化学试题A卷
5 . 下面是某些短周期元素电负性(X)的值:
回答下列问题:
(1)通过分析X值的变化规律,确定 的范围是:
的范围是:___________ 。推测X值与原子半径的关系是___________ 。
(2)X值最小的元素(放射性元素除外)在元素周期表中的位置是___________ ;X值最大的元素基态原子核外电子的空间运动状态有___________ 种。
(3)经验规律告诉我们,当成键的两原子的X差值,即 时,一般为离子键,当
时,一般为离子键,当 时,一般为共价键。试推断
时,一般为共价键。试推断 中化学键的类型为
中化学键的类型为___________ 。请设计一个实验方案证明上所得到的结论:___________ 。
(4)利用苯氨可以去除空气中的甲醛,利用电负性相关知识预测反应产物: +HCHO
+HCHO___________ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 第二周期 |  |  | B | C | O | ||
| X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | ||
| 第三周期 |  |  |  | P | S |  | |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析X值的变化规律,确定
 的范围是:
的范围是:(2)X值最小的元素(放射性元素除外)在元素周期表中的位置是
(3)经验规律告诉我们,当成键的两原子的X差值,即
 时,一般为离子键,当
时,一般为离子键,当 时,一般为共价键。试推断
时,一般为共价键。试推断 中化学键的类型为
中化学键的类型为(4)利用苯氨可以去除空气中的甲醛,利用电负性相关知识预测反应产物:
 +HCHO
+HCHO
您最近一年使用:0次
名校
6 . I、如图表示元素周期表中部分元素的某种性质(X值)随原子序数变化的关系示意图。

(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是_______ (填元素符号)。
(2)预测S元素与 元素x值的大小关系为
元素x值的大小关系为_______ ,x值最小的元素在元素周期表中的位置是_______ (放射性元素除外)。
(3)下列关于元素性质的说法正确的是_______ (填标号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
II、今有① 、②HCl、③
、②HCl、③ 三种溶液,根据要求回答下列问题:
三种溶液,根据要求回答下列问题:
(4)pH相同的三种酸溶液各lmL,加水稀释相同倍数后,溶液中水电离出来的 的关系为
的关系为_______ 。(用序号填空,下同)
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为_______ 。
(6)中和等体积相同浓度的烧碱溶液,需同浓度的三种溶液的体积分别为 、
、 、
、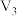 ,则
,则 、
、 、
、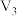 的关系为
的关系为_______ (用等式表示)。
III.平衡思想是化学研究的一个重要观念,在水溶液中存在多种平衡体系。
(7)实验室在保存FeCl3溶液时,常在溶液中加少量的_______ ,以抑制其水解;把 溶液蒸干并灼烧,最后得到的固体主要产物是
溶液蒸干并灼烧,最后得到的固体主要产物是_______ 。
(8)在日常生活中经常用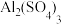 和
和 混合溶液作灭火剂,请用离子方程式表示其灭火原理:
混合溶液作灭火剂,请用离子方程式表示其灭火原理:_______ 。

(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是
(2)预测S元素与
 元素x值的大小关系为
元素x值的大小关系为(3)下列关于元素性质的说法正确的是
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
II、今有①
 、②HCl、③
、②HCl、③ 三种溶液,根据要求回答下列问题:
三种溶液,根据要求回答下列问题:(4)pH相同的三种酸溶液各lmL,加水稀释相同倍数后,溶液中水电离出来的
 的关系为
的关系为(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
(6)中和等体积相同浓度的烧碱溶液,需同浓度的三种溶液的体积分别为
 、
、 、
、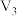 ,则
,则 、
、 、
、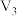 的关系为
的关系为III.平衡思想是化学研究的一个重要观念,在水溶液中存在多种平衡体系。
(7)实验室在保存FeCl3溶液时,常在溶液中加少量的
 溶液蒸干并灼烧,最后得到的固体主要产物是
溶液蒸干并灼烧,最后得到的固体主要产物是(8)在日常生活中经常用
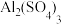 和
和 混合溶液作灭火剂,请用离子方程式表示其灭火原理:
混合溶液作灭火剂,请用离子方程式表示其灭火原理:
您最近一年使用:0次
解题方法
7 . 治疗新冠肺炎药物瑞德西韦的主要成分结构如图。下列说法错误的是


A.分子中存在 键、 键、 键 键 |
B.分子中的 键的键能小于 键的键能小于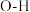 键的键能 键的键能 |
C.分子中N、O、P原子的第一电离能由大到小的关系为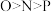 |
| D.分子中含有手性碳原子 |
您最近一年使用:0次
2022-01-23更新
|
447次组卷
|
4卷引用:山东省烟台市华夏学校2021-2022学年高二上学期期中考试化学试题
山东省烟台市华夏学校2021-2022学年高二上学期期中考试化学试题辽宁省锦州市2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题
8 . N2F4可作高能燃料的氧化剂,它可由以下反应制得:HNF2+Fe3+→N2F4↑+Fe2++H+(未配平)。下列说法错误的是
| A.N2F4分子中N-F键键角小于N2H4分子中N-H键键角 |
| B.上述反应中,氧化剂与还原剂的物质的量之比为1:1 |
| C.若生成标准状况下2.24LN2F4,转移电子0.2mol |
| D.N2F4作氧化剂时,其还原产物可能是N2和HF |
您最近一年使用:0次
2021-12-21更新
|
665次组卷
|
7卷引用:山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题
山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题1-5)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 二轮专题突破 专题5 氧化还原反应的概念,规律及应用(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
9 . 光气(COCl2)是一种重要的有机中间体。可用反应CHCl3+H2O2=COCl2↑+HCl+H2O制备光气。下列叙述错误的是
| A.CHCl3为极性分子 |
| B.电负性:O>Cl>C |
C.基态Cl原子的价电子轨道表示式: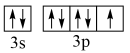 |
| D.COCl2中碳原子的杂化类型为sp3杂化 |
您最近一年使用:0次
2021-12-21更新
|
363次组卷
|
3卷引用:山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题
山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江苏省阜宁中学2022-2023学年高二上学期期中考试化学试题
解题方法
10 . 在工业上用磷化铜(Cu3P2)制造磷青铜,磷青铜是含少量钪、锡、磷的铜合金,主要用作耐磨零件和弹性合金原件。
(1)基态Sc原子的价电子排布式为_______ ;同周期中未成对电子数与Sc相同的元素有_______ 种。
(2)磷青铜中的锡、磷两种元素电负性的大小为Sn_______ P(填“>”“<”或“=”)。
(3)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是_______ 。[Cu(NH3)4]2+中2个NH3被2个H2O取代,得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是_______ (填“正四面体”或“正四边形”)。
(4)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为_______ 。
②若晶体密度为ρg/cm3,最近的Cu原子核间距为_______ pm(用含ρ、NA的代数式表示)。
(1)基态Sc原子的价电子排布式为
(2)磷青铜中的锡、磷两种元素电负性的大小为Sn
(3)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是
(4)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg/cm3,最近的Cu原子核间距为
您最近一年使用:0次
2021-12-16更新
|
303次组卷
|
3卷引用:山东省潍坊市2021-2022学年高三上学期12月月考化学试题
山东省潍坊市2021-2022学年高三上学期12月月考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖北省十堰市普通高中六校联合体2022-2023高二下学期5月月考化学试题



