解题方法
1 . 含硼物质在生产生活中有着广泛应用。回答下列问题:
(1)基态硼原子的价电子轨道表示式是___________ ,最高能量的原子轨道的空间形状是___________ 。
(2)BN可以水解成硼酸(H3BO3)和NH3,B、N、O中,第一电离能最大的元素是___________ 。人工合成的一种BN晶体硬度已超过金刚石,是一种超硬材料,常用作刀具材料和磨料。可预测该BN晶体属于___________ 晶体。用___________ 法可以测得该晶体的结构,其中B的化合价为___________ ,请解释原因:___________ 。
(3)N-甲基咪唑的结构为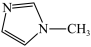 ,它的某种衍生物与NaBF4形成的离子化合物
,它的某种衍生物与NaBF4形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
①0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为___________ ;
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一、以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷。为测定该配合物的结构,取2.32 g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59 g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06 mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71 g。
I.该配合物中镍离子的基态电子排布式为___________ 。
Ⅱ.该配合物的结构简式为___________ 。
(1)基态硼原子的价电子轨道表示式是
(2)BN可以水解成硼酸(H3BO3)和NH3,B、N、O中,第一电离能最大的元素是
(3)N-甲基咪唑的结构为
 ,它的某种衍生物与NaBF4形成的离子化合物
,它的某种衍生物与NaBF4形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①1mol离子化合物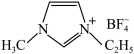 中,阿伏加德罗常数的值为NA,则根据价电子对互斥(VSEPR)理论,杂化方式为sp3的原子共有
中,阿伏加德罗常数的值为NA,则根据价电子对互斥(VSEPR)理论,杂化方式为sp3的原子共有 的电子式为
的电子式为
②离子化合物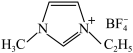 熔点低的原因是
熔点低的原因是
①0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一、以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷。为测定该配合物的结构,取2.32 g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59 g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06 mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71 g。
I.该配合物中镍离子的基态电子排布式为
Ⅱ.该配合物的结构简式为
您最近一年使用:0次
名校
解题方法
2 . 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
(1)X基态原子的电子排布式为______ .
(2)C、H、O三种原子的电负性由大到小的顺序为______ .
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:
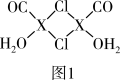
①与CO为互为等电子体的分子是______ .
②该配合物中氯原子的杂化方式为______ .
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______ .
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______ .XCl的化学式__________

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=_____________ (无需化简,列式即可)。
(1)X基态原子的电子排布式为
(2)C、H、O三种原子的电负性由大到小的顺序为
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:

①与CO为互为等电子体的分子是
②该配合物中氯原子的杂化方式为
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=
您最近一年使用:0次



