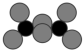
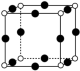
解题方法
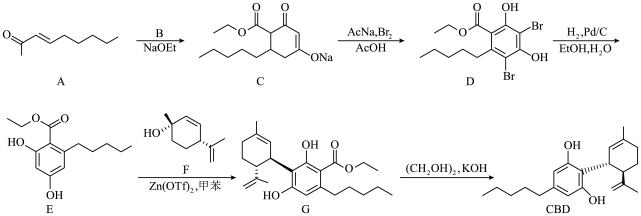
1 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为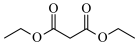 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
(5)已知:R-CN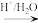 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成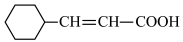 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
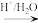 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成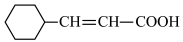 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近一年使用:0次
2 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: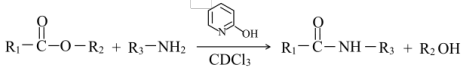 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
名校
解题方法
3 . 有机物K合成路线如下图 (部分条件已省略)。

已知:
①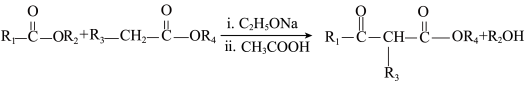
②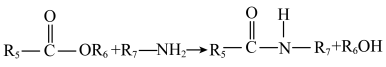 (
( 表示烃基)。
表示烃基)。
请回答下列问题。
(1)K的分子式为_______ 。
(2)A中官能团的名称是_______ ,G→H的反应类型是_______ 。
(3)B→D的化学方程式为_______ 。
(4)F→G中NaOH的作用是_______ 。
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:_______ 。(元素电负性:H-2.1 C-2.5 O-3.5)
(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为_______ 。
②Q和K是互变异构关系,K比Q稳定的原因是_______ 。
(7)X是D的同分异构体,符合下列条件的X的结构简式是_______ 。
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

已知:
①
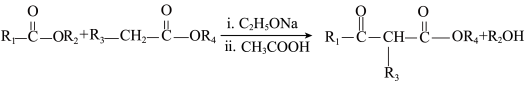
②
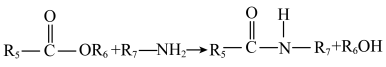 (
( 表示烃基)。
表示烃基)。请回答下列问题。
(1)K的分子式为
(2)A中官能团的名称是
(3)B→D的化学方程式为
(4)F→G中NaOH的作用是
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和
 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为
②Q和K是互变异构关系,K比Q稳定的原因是
(7)X是D的同分异构体,符合下列条件的X的结构简式是
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3
您最近一年使用:0次
名校
解题方法
4 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,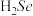 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型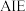 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠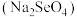 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒,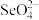 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
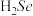 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。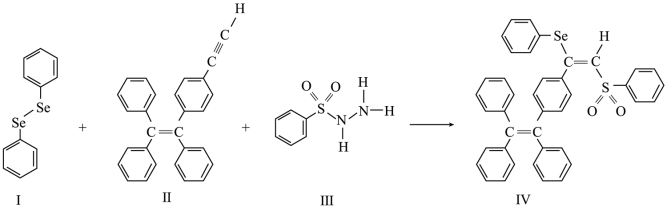
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与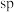 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠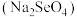 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒,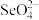 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近一年使用:0次
解题方法
5 . 化合物F是一种重要的有机合成中间体,某研究小组按下列路线进行合成:
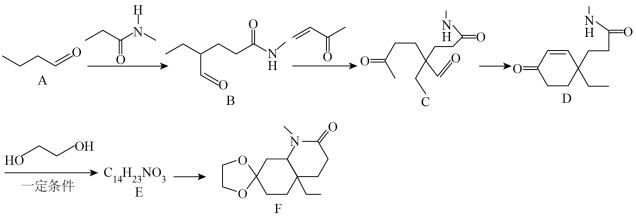
已知: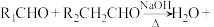
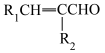
请回答下列问题:
(1)有机物B所含的官能团名称是___________ ,B→C的反应类型为___________ 。
(2)化合物E的结构简式是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)1分子有机物F分子中含有的手性碳原子数为___________ 。
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为___________ ,第一电离能最大的为___________ (填元素符号)。
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:___________ (任写一种)。
①IR谱检测表明:分子中含有一个苯环,有 键,无
键,无 、
、 键。
键。
② 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。
③仅含有两种官能团,其中一种为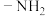 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。

已知:
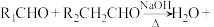
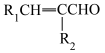
请回答下列问题:
(1)有机物B所含的官能团名称是
(2)化合物E的结构简式是
(3)写出D→E的化学方程式:
(4)1分子有机物F分子中含有的手性碳原子数为
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:
①IR谱检测表明:分子中含有一个苯环,有
 键,无
键,无 、
、 键。
键。②
 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。③仅含有两种官能团,其中一种为
 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。
您最近一年使用:0次
6 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
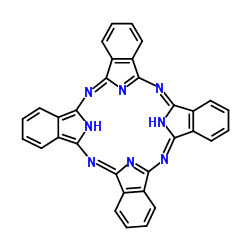
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(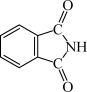 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
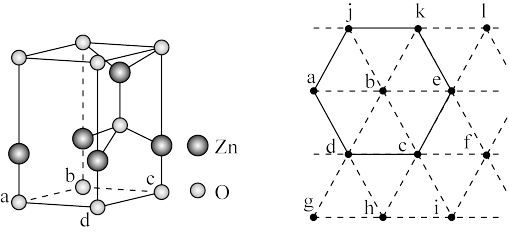
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9010次组卷
|
11卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)2022年海南省高考真题变式题15-19山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)