1 . 一般认为,含氧酸酸性强弱主要与两个因素有关:一是中心原子的电负性越大,酸性越强:一是中心原子所连接的“非羟基氧”数目越多,酸性越强。据此推断下列说法正确的是
A. 是一种二元强酸 是一种二元强酸 |
B.H3PO2的分子结构是 ,它是一种三元弱酸 ,它是一种三元弱酸 |
| C.HPO3、 HClO3、HClO4的酸性依次增强 |
D.某元素X形成的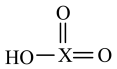 比HO-X的酸性强,氧化性也强 比HO-X的酸性强,氧化性也强 |
您最近一年使用:0次
2022-05-27更新
|
920次组卷
|
3卷引用:山东省名校联盟2022届高三下学期5月模拟考试化学试题
名校
解题方法
2 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 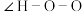 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: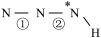 ,
, 为
为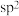 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为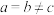 ,
,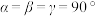 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
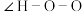 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: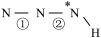 ,
, 为
为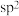 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为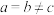 ,
,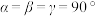 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。已知:常温下H2S溶解度为1∶2.6(体积)。下图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
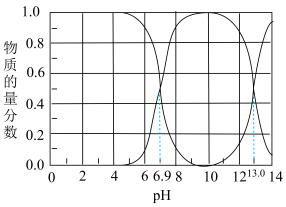
(1)由图判断,H2S的一级电离平衡常数为Ka1=___________ 。
(2)25℃,HS-电离程度小于水解程度,依据是:___________ 。
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是___________ 。
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:___________ 。
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是___________ 。
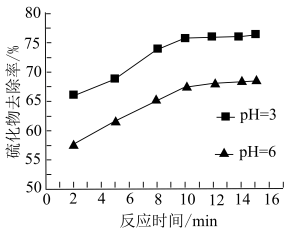
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。
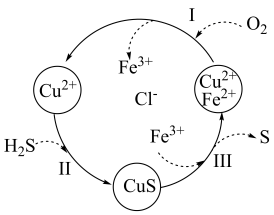
(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
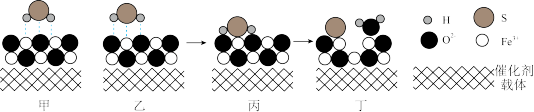
Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因___________ 。

(1)由图判断,H2S的一级电离平衡常数为Ka1=
(2)25℃,HS-电离程度小于水解程度,依据是:
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________

| A.转化过程中参与循环的离子只有Fe2+ |
| B.转化过程有四种元素的化合价发生了变化 |
| C.过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ |
| D.氧化性由强到弱的顺序:O2 >Fe3+> S |
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。

Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因
您最近一年使用:0次
解题方法
4 . 碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
(1)铝的基态原子的价电子排布式是_________________ 。
(2)用水解法制备一种磁性材料铁氧体时常加入尿素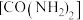 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________ ,分子中 键和
键和 键的数目之比为
键的数目之比为__________ 。醋酸钠中碳原子的杂化类型为____________ 。
(3)Mg2+、 等金属离子与
等金属离子与 、
、 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________  填“
填“ ”或“
”或“ ”
” ,其原因是
,其原因是__________ ;已知氨 熔点:
熔点: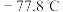 、沸点:
、沸点: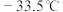 ,联氨
,联氨 熔点:
熔点: 、沸点:
、沸点: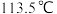 ,解释其熔沸点高低的主要原因:
,解释其熔沸点高低的主要原因:______________ 。
(4)碳溶解在 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________ 。若晶体密度为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为__________ 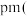 阿伏加 德罗常数的值用
阿伏加 德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 。
。

(1)铝的基态原子的价电子排布式是
(2)用水解法制备一种磁性材料铁氧体时常加入尿素
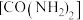 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是 键和
键和 键的数目之比为
键的数目之比为(3)Mg2+、
 等金属离子与
等金属离子与 、
、 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是 填“
填“ ”或“
”或“ ”
” ,其原因是
,其原因是 熔点:
熔点: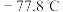 、沸点:
、沸点: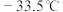 ,联氨
,联氨 熔点:
熔点: 、沸点:
、沸点: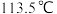 ,解释其熔沸点高低的主要原因:
,解释其熔沸点高低的主要原因:(4)碳溶解在
 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为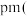 阿伏加 德罗常数的值用
阿伏加 德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 。
。 
您最近一年使用:0次
2020-01-27更新
|
189次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——物质结构与性质
解题方法
5 . 物质的结构决定物质的性质。请回答下列问题:
(1)下列有关物质结构与性质的说法中错误的有_______ (填标号)。
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
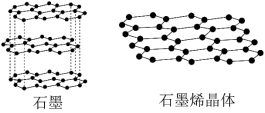
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是_______ ,12g石墨烯中由碳原子连接成的六元环的物质的量约为_______ mol。
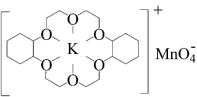
(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是_______ 。
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是_______ 。
KMnO4+

(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
(5)硅的含氧化合物都以硅氧四面体(SiO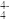 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为_______ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为_______ 。
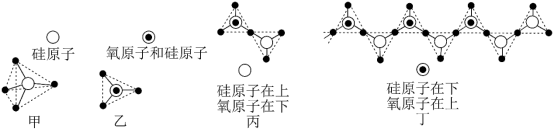
(1)下列有关物质结构与性质的说法中错误的有
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是

(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是
KMnO4+



(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
| A.苯 | B.三氧化硫 | C.四氯化碳 | D.环己烷 |
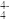 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为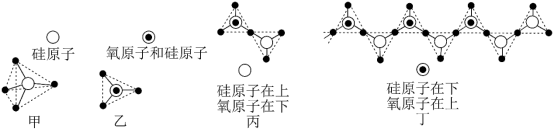
您最近一年使用:0次
解题方法
6 . 卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I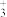 )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
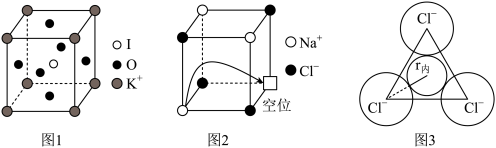
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: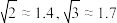 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
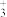 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
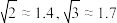 )
)
您最近一年使用:0次



