名校
解题方法
1 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
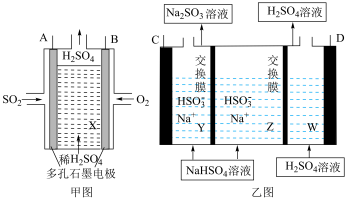
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
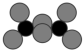
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D. |
您最近一年使用:0次
名校
解题方法
2 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,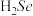 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
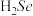 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近一年使用:0次
名校
解题方法
3 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
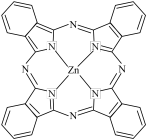
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
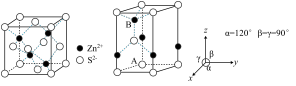
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
解题方法
4 . 如图甲,铜离子与有机物HA可形成一种螯合物 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
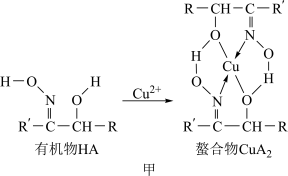
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+ CuA2+2H+
CuA2+2H+
回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是_______ 。
(3)螯合物 中的氮原子杂化方式为
中的氮原子杂化方式为_______ ,氧原子的杂化方式为_______ 。
(4)下列关于螯合物 的说法中,正确的是
的说法中,正确的是_______ (填序号)。
① 中O的配位能力比N强
中O的配位能力比N强
②与 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型
③ 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂
④每个 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键
(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是_______ 。
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数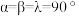 ,
, ,
,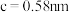 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
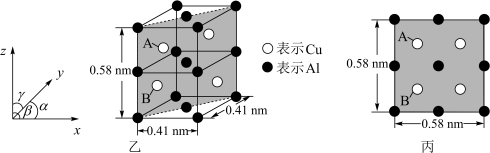
该晶体的化学式为_______ ,密度为_______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+
 CuA2+2H+
CuA2+2H+回答下列问题:
(1)基态铜原子的价电子排布式为
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是
(3)螯合物
 中的氮原子杂化方式为
中的氮原子杂化方式为(4)下列关于螯合物
 的说法中,正确的是
的说法中,正确的是①
 中O的配位能力比N强
中O的配位能力比N强②与
 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型③
 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂④每个
 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数
 ,
, ,
, ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
解题方法
5 . 物质的结构决定物质的性质。请回答下列问题:
(1)下列有关物质结构与性质的说法中错误的有_______ (填标号)。
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
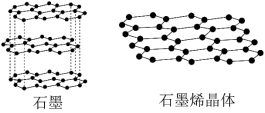
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是_______ ,12g石墨烯中由碳原子连接成的六元环的物质的量约为_______ mol。
(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是_______ 。
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是_______ 。
KMnO4+

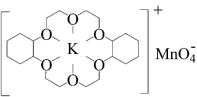
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
(5)硅的含氧化合物都以硅氧四面体(SiO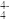 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为_______ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为_______ 。
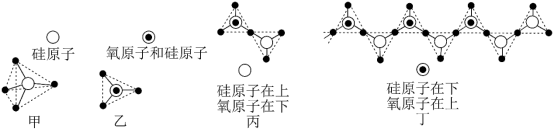
(1)下列有关物质结构与性质的说法中错误的有
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是

(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是
KMnO4+



(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
| A.苯 | B.三氧化硫 | C.四氯化碳 | D.环己烷 |
 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为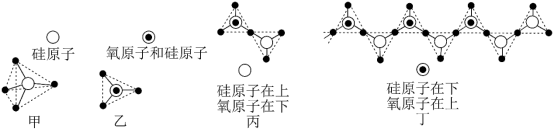
您最近一年使用:0次
解题方法
6 . 2020年某科研团队经多次实验发现一种新型漂白剂(结构见下图),可用于漂白蚕丝等织品,其组成元素均为短周期元素,W、X对应的简单离子核外电子排布相同,且W、Y、Z的最外层电子数之和等于X的最外层电子数,下列说法错误的是


| A.四种元素中X的电负性最大 |
| B.该物质中含有2mol配位键 |
| C.Y的最高价氧化物的水化物是一元弱酸 |
| D.离子半径:Z+˂W2+<X2- |
您最近一年使用:0次
解题方法
7 . 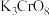 、
、 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
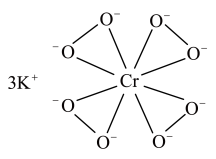
(1)基态Cr原子的未成对电子数为________________ 。
(2)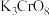 的结构如图所示。
的结构如图所示。
①下列有关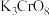 的说法正确的是
的说法正确的是__________ (填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,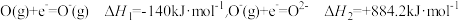 。氧的第一电子亲和能E1为
。氧的第一电子亲和能E1为__________ kJ/mol;△H2>0,其原因是_____________________________________ 。
(3)雷氏盐的化学式为 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________ 。
②其阳离子的中心原子的杂化方式为_________________ ,配体之一NH3分子的立体构型为______ 。
③与配体NCSˉ互为等电子体的阴离子有 等,分子有
等,分子有_____________________ (写1种);画出 的结构式:
的结构式:_____________________________ 。
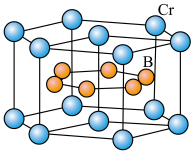
(4) 的晶体密度为
的晶体密度为 ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加 德罗常数的值为NA,则a2c=
,设阿伏加 德罗常数的值为NA,则a2c=_______________ (列出计算式)。
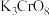 、
、 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)
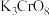 的结构如图所示。
的结构如图所示。①下列有关
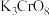 的说法正确的是
的说法正确的是A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
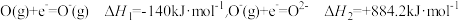 。氧的第一电子亲和能E1为
。氧的第一电子亲和能E1为(3)雷氏盐的化学式为
 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②其阳离子的中心原子的杂化方式为
③与配体NCSˉ互为等电子体的阴离子有
 等,分子有
等,分子有 的结构式:
的结构式:(4)
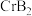 的晶体密度为
的晶体密度为 ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加 德罗常数的值为NA,则a2c=
,设阿伏加 德罗常数的值为NA,则a2c=
您最近一年使用:0次