1 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
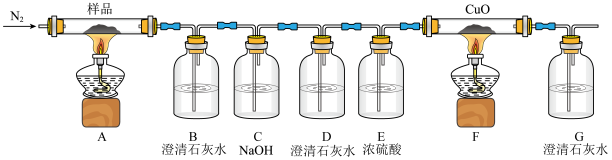
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
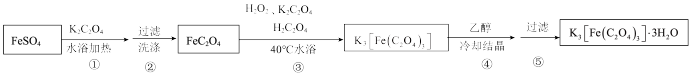
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
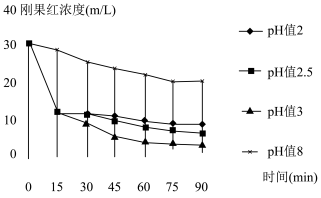
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
名校
解题方法
2 . 100mL 甲溶液可能含有H+、K+、NH 、Ba2+、CO
、Ba2+、CO 、SO
、SO 、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是

 、Ba2+、CO
、Ba2+、CO 、SO
、SO 、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
| A.原溶液一定不存在 H+、Ba2+,可能存在K+,可通过焰色试验来检验 |
| B.原溶液一定存在Cl-, 且c(Cl-)≤0.1mol/L |
| C.沉淀1转化为沉淀2时,放出的气体标况下的体积为224mL |
D.若甲溶液中先加 BaCl2溶液,产生白色沉淀,再加足量稀盐酸沉淀不溶解,不能证明此溶液中含有SO |
您最近一年使用:0次
2023-11-08更新
|
522次组卷
|
2卷引用: 四川省成都市树德中学2023-2024学年高一上学期11月期中考试化学试题
3 . I.大气的成分在工业上有重要的应用。
(1)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是_______ (填序号)。
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N-H键形成
③混合气体的密度不再改变的状态
④混合气体的压强不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
(2)为提高H2的转化率,实际生产中宜采取的措施是_______ (填字母)。
II.中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉。已知CO2经催化加氢可以生成多种低碳有机物。
已知:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) △H2=+40.9kJ•mol-1
CO(g)+H2O(g) △H2=+40.9kJ•mol-1
③CO(g)+2H2(g) CH3OH(g) △H3
CH3OH(g) △H3
回答下列问题:
(3)反应③的△H3为_______ 。
(4)一定温度下,在一体积固定的密闭容器中进行反应①,测得CO2的物质的量浓度随反应时间的变化如图所示,则反应进行的前5分钟内,v(H2)=_______ ;10min时,改变的外界条件可能是_______ 。

(5)已知一定温度下按照起始比 =2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
=2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=_______ (各气体分压=平衡体系中各气体的体积分数×总压)。
(1)在恒容密闭容器中,发生反应N2(g)+3H2(g)
 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N-H键形成
③混合气体的密度不再改变的状态
④混合气体的压强不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
(2)为提高H2的转化率,实际生产中宜采取的措施是
| A.及时移出氨 | B.适当增大压强 | C.减小压强 | D.降低温度 |
II.中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉。已知CO2经催化加氢可以生成多种低碳有机物。
已知:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+40.9kJ•mol-1
CO(g)+H2O(g) △H2=+40.9kJ•mol-1③CO(g)+2H2(g)
 CH3OH(g) △H3
CH3OH(g) △H3回答下列问题:
(3)反应③的△H3为
(4)一定温度下,在一体积固定的密闭容器中进行反应①,测得CO2的物质的量浓度随反应时间的变化如图所示,则反应进行的前5分钟内,v(H2)=

(5)已知一定温度下按照起始比
 =2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
=2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
您最近一年使用:0次
名校
4 . 醇酸树脂是一种成膜性很好的树脂,下面是一种醇酸树脂的合成
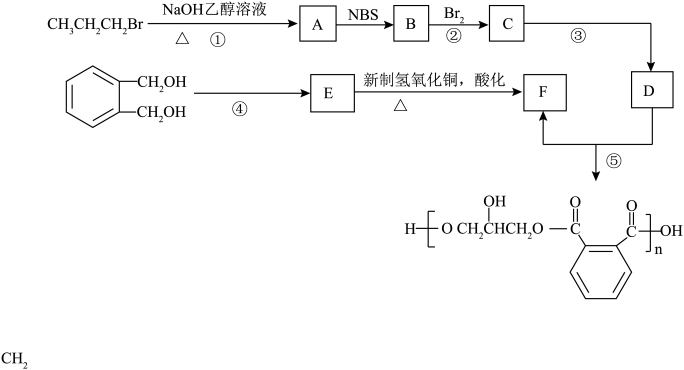
已知:
(1)D的化学名称是___________ ,B中含有的官能团的名称是___________ 。
(2)③的反应的类型是___________ ,反应试剂与条件为___________ 。
(3)④的反应试剂与条件为___________ ,①的反应方程式为___________ 。
(4)下列说法正确的是___________。
(5)下列关于F的说法正确的是___________。
(6)含有相同官能团的有机物通常具有相似的化学性质,因此可以预测醇酸树脂具有与___________ 化合物相似的化学性质(填写物质类别)。
(7)化合物X是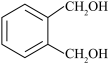 的同分异构体,能与
的同分异构体,能与 溶液发生显色反应,
溶液发生显色反应, 最多消耗
最多消耗 ,其中有五种不同的等效氢,个数比为
,其中有五种不同的等效氢,个数比为 ,则所有符合结构的有机物结构简式
,则所有符合结构的有机物结构简式___________ 。
(8)工业上可用丙烯氧化法生产丙烯酸 ,得到的丙烯酸中往往混有丙烯醛
,得到的丙烯酸中往往混有丙烯醛 ,证明生成的丙烯酸中混有丙烯醛的方法是:
,证明生成的丙烯酸中混有丙烯醛的方法是:________ 。

已知:

(1)D的化学名称是
(2)③的反应的类型是
(3)④的反应试剂与条件为
(4)下列说法正确的是___________。
| A.醇酸树脂是纯净物 | B.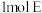 与足量的银氨溶液反应能生成 与足量的银氨溶液反应能生成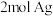 |
| C.E能使酸性高锰酸钾溶液褪色 | D.反应⑤是加聚反应 |
| A.所有原子一定都在同一平面上 | B.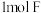 最多可与 最多可与 氢气发生加成反应 氢气发生加成反应 |
| C.至少有12个原子在同一平面上 | D.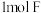 与足量 与足量 溶液反应得 溶液反应得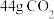 |
(7)化合物X是
 的同分异构体,能与
的同分异构体,能与 溶液发生显色反应,
溶液发生显色反应, 最多消耗
最多消耗 ,其中有五种不同的等效氢,个数比为
,其中有五种不同的等效氢,个数比为 ,则所有符合结构的有机物结构简式
,则所有符合结构的有机物结构简式(8)工业上可用丙烯氧化法生产丙烯酸
 ,得到的丙烯酸中往往混有丙烯醛
,得到的丙烯酸中往往混有丙烯醛 ,证明生成的丙烯酸中混有丙烯醛的方法是:
,证明生成的丙烯酸中混有丙烯醛的方法是:
您最近一年使用:0次
名校
解题方法
5 . 醇酸树脂是一种成膜性很好的树脂,下面是一种醇酸树脂的合成线路线:
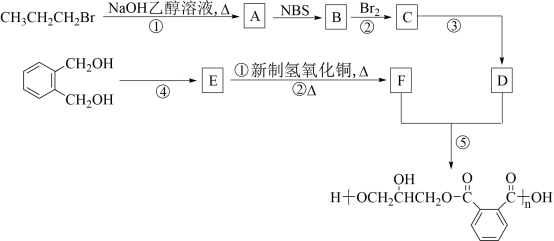
已知: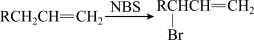
(1)D的化学名称是_______ ,B中含有的官能团的名称是_______ ,③的反应的类型是_______ 。
(2)③的反应试剂与条件为_______ ,④的反应试剂与条件为_______ ,①的反应方程式为_______ 。
(3)下列说法正确的是_______。
(4)工业上大量获得A的方法是_______。
(5)下列关于F的说法正确的是_______。
(6)含有相同官能团的有机物通常具有相似的化学性质,因此可以预测醇酸树脂具有与_______ 化合物相似的化学性质(填写物质类别)。
(7)化合物X是 的同分异构体,能与
的同分异构体,能与 溶液发生显色反应,1moX最多消耗1molNa,其中有五种不同的等效氢,个数比为1:2:2:2:3,则其结构简式为
溶液发生显色反应,1moX最多消耗1molNa,其中有五种不同的等效氢,个数比为1:2:2:2:3,则其结构简式为_______ 。(写出一种即可)
(8)工业上可用丙烯氧化法生产丙烯酸(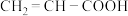 ),得到的丙烯酸中往往混有丙烯醛(
),得到的丙烯酸中往往混有丙烯醛(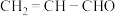 ),证明生成的丙烯酸中混有丙烯醛的方法是:
),证明生成的丙烯酸中混有丙烯醛的方法是:_______ 。

已知:
(1)D的化学名称是
(2)③的反应试剂与条件为
(3)下列说法正确的是_______。
| A.醇酸树脂是纯净物 | B.1mol E与足量的银氨溶液反应能生成2mol Ag |
| C.E能使酸性高锰酸钾溶液褪色 | D.反应⑤是加聚反应 |
| A.石油裂解 | B.丙醇脱水 | C.石油分馏 | D.煤的干馏 |
| A.所有原子一定都在同一平面上 | B.1molF最多可与5mol氢气发生加成反应 |
| C.至少有12个原子在同一平面上 | D.1molF与足量 溶液反应得44g 溶液反应得44g |
(7)化合物X是
 的同分异构体,能与
的同分异构体,能与 溶液发生显色反应,1moX最多消耗1molNa,其中有五种不同的等效氢,个数比为1:2:2:2:3,则其结构简式为
溶液发生显色反应,1moX最多消耗1molNa,其中有五种不同的等效氢,个数比为1:2:2:2:3,则其结构简式为(8)工业上可用丙烯氧化法生产丙烯酸(
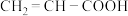 ),得到的丙烯酸中往往混有丙烯醛(
),得到的丙烯酸中往往混有丙烯醛(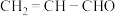 ),证明生成的丙烯酸中混有丙烯醛的方法是:
),证明生成的丙烯酸中混有丙烯醛的方法是:
您最近一年使用:0次
2023-03-17更新
|
383次组卷
|
2卷引用:上海市建平中学2022-2023学年高二下学期3月测试化学(B 卷)试题
名校
6 . 向 稀
稀 与稀
与稀 的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是
的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是
 稀
稀 与稀
与稀 的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是
的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是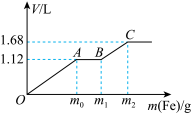
A.OA段产生的气体是NO,BC段产生的气体是 |
B.该实验可以证明氧化性: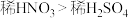 |
C.参加反应铁粉的总质量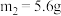 |
D.所用混合溶液中 |
您最近一年使用:0次
2023-04-15更新
|
480次组卷
|
3卷引用:湖北省鄂东南重点中学2022-2023学年高一下学期期中联考化学试题
名校
解题方法
7 . 室温下,通过下列实验探究NaHS溶液的性质。
实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量 溶液,产生黑色沉淀
溶液,产生黑色沉淀
下列有关说法正确的是
实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量
 溶液,产生黑色沉淀
溶液,产生黑色沉淀下列有关说法正确的是
A.实验1证明: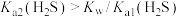 |
B.实验2证明: 不能被 不能被 氧化 氧化 |
C.实验3中所得溶液中: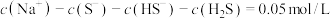 |
D.实验4反应静置后的上层清液中有 |
您最近一年使用:0次
2023-01-08更新
|
571次组卷
|
3卷引用:江苏省决胜新高考2023届高三上学期12月大联考化学试题
8 . 向AgNO3溶液中通入过量SO2,过程和现象如图。

经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag。
下列说法不正确的是

经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag。
下列说法不正确的是
| A.①中生成白色沉淀的离子方程式为2Ag++SO2+H2O=Ag2SO3↓+2H+ |
| B.①中未生成Ag2SO4,证明溶度积:Ksp(Ag2SO3)<Ksp(Ag2SO4) |
| C.②中的现象体现了Ag+的氧化性 |
| D.该实验条件下,SO2与AgNO3反应生成Ag2SO3的速率大于生成Ag的速率 |
您最近一年使用:0次
2022-05-15更新
|
2164次组卷
|
12卷引用:北京市海淀区2022届高三二模化学试题
北京市海淀区2022届高三二模化学试题北京市海淀区2021-2022学年高三下学期期末练习化学试题河南省南阳市第一中学校2023届高三上学期第二次阶段考试化学试题北京市第二十中学2022-2023学年高二上学期期末考试化学试题广东省昌乐市第一中学2022-2023学年高三上学期期末质量检测化学试题江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题江苏省百校联考2022-2023学年高二下学期5月第一次考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题辽宁省沈阳市第二中学2023-2024学年高三上学期期末模拟考试化学试题北京市第十三中学2023-2024学年高三上学期开学考化学试卷 北京市中关村中学2023-2024学年高三下学期3月月考化学试题
名校
9 . NH4Cl在生产生活中有重要的用途。某化学小组尝试制备NH4Cl并探究NH4Cl的某些性质,进行了以下实验:
(1)该小组用NH3和HCl合成NH4Cl。
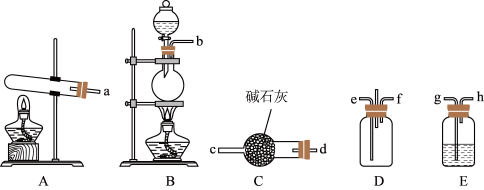
①写出用A装置制备NH3的化学方程式_______ 。
②为使NH3和HCl在D中充分混合并反应,上述装置的连接顺序为a→d→c→_______ 、_______ ←h←g←b。B中圆底烧瓶中放NaCl固体,则分液漏斗中的试剂为_______ 。
③装置D处除易堵塞导管外,还有不足之处为_______ 。
(2)该小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:a.CH3COONH4溶液呈中性;b.Cl—对该反应几乎无影响。
①经检验实验2中刺激性气味气体为NH3,检验方法是_______ 。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
②已知灰白色沉淀中含有Mg2+、OH—。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。灰白色固体可能是_______ (填化学式)。
③甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
试剂X是_______ 。
④为进一步探究实验2反应剧烈的原因,进行实验4:
依据上述实验,可以得出Mg能与NH 反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是_______ 。
⑤实验总结:通过上述实验,该小组同学得出Mg能与NH 反应生成H2的结论。
反应生成H2的结论。
(1)该小组用NH3和HCl合成NH4Cl。

①写出用A装置制备NH3的化学方程式
②为使NH3和HCl在D中充分混合并反应,上述装置的连接顺序为a→d→c→
③装置D处除易堵塞导管外,还有不足之处为
(2)该小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:a.CH3COONH4溶液呈中性;b.Cl—对该反应几乎无影响。
| 实验 | 实验试剂 | 实验现象 |
| 1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生 (经检验为H2) |
| 2 | 5mL 1.0mol/L NH4Cl溶液 (pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
②已知灰白色沉淀中含有Mg2+、OH—。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。灰白色固体可能是
③甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
| 实验 | 实验装置 | 现象 |
| 3 | 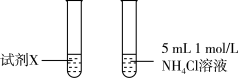 | 两试管反应剧烈程度相当 |
④为进一步探究实验2反应剧烈的原因,进行实验4:
| 实验 | 实验试剂 | 实验现象 |
| 4 | 5mL NH4Cl乙醇溶液 | 有无色无味气体产生 (经检验为H2) |
 反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是⑤实验总结:通过上述实验,该小组同学得出Mg能与NH
 反应生成H2的结论。
反应生成H2的结论。
您最近一年使用:0次
2022-03-07更新
|
1132次组卷
|
3卷引用:广东省广州市执信中学2022届高三下学期联考化学试题
广东省广州市执信中学2022届高三下学期联考化学试题广东省珠海市第二中学2021-2022学年高三下学期3000分第四次考试化学试题(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
名校
10 . 蕴藏在海底的大量“可燃冰”(甲烷的水合物)是一种清洁燃料,其开发利用是解决能源危机的重要课题。在一定条件下 与
与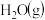 可发生反应:
可发生反应:

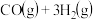 ,该反应的能量变化如下图所示。
,该反应的能量变化如下图所示。
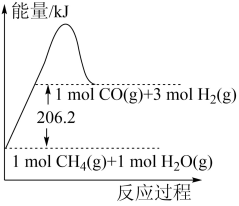
请回答下列问题:
(1)请用电子式表示CH4的形成过程_______ 。
(2)在一定条件下,由一定量的 和
和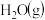 反应生成了
反应生成了 和6molH2(g)时所吸收的热量为
和6molH2(g)时所吸收的热量为_______ kJ。
(3)下列措施中可以加快该反应的化学反应速率的是_______  填字母
填字母 。
。
A.恒温恒容条件下,向其中充入
B.恒温恒压条件下,向其中充入
C.恒温恒容条件下,向其中充入
D.其他条件不变,降低温度
E.其他条件不变,减小容器的体积
F.其他条件不变,及时分离出生成的H2
(4)T℃下,在容积为2L的恒容密闭容器中通入 和
和 发生该反应。
发生该反应。
①下列说法中能证明该反应已达到化学平衡状态的是_______  填字母
填字母 。
。
A.单位时间内消耗
 的同时生成了
的同时生成了
B.一个 键断裂的同时有三个
键断裂的同时有三个 键断裂
键断裂
C.密闭容器中混合气体的密度不再变化
D.混合气体的平均相对分子质量不再变化
E.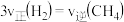
F.密闭容器内总压强不再变化
②若该反应达到化学平衡状态时,容器内气体的压强变为起始压强的1.6倍,则达平衡时 的转化率为
的转化率为_______ ,CO的体积分数为_______ %(计算结果保留一位小数 )。
 与
与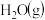 可发生反应:
可发生反应:

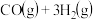 ,该反应的能量变化如下图所示。
,该反应的能量变化如下图所示。
请回答下列问题:
(1)请用电子式表示CH4的形成过程
(2)在一定条件下,由一定量的
 和
和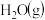 反应生成了
反应生成了 和6molH2(g)时所吸收的热量为
和6molH2(g)时所吸收的热量为(3)下列措施中可以加快该反应的化学反应速率的是
 填字母
填字母 。
。A.恒温恒容条件下,向其中充入

B.恒温恒压条件下,向其中充入

C.恒温恒容条件下,向其中充入
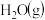
D.其他条件不变,降低温度
E.其他条件不变,减小容器的体积
F.其他条件不变,及时分离出生成的H2
(4)T℃下,在容积为2L的恒容密闭容器中通入
 和
和 发生该反应。
发生该反应。①下列说法中能证明该反应已达到化学平衡状态的是
 填字母
填字母 。
。A.单位时间内消耗

 的同时生成了
的同时生成了
B.一个
 键断裂的同时有三个
键断裂的同时有三个 键断裂
键断裂C.密闭容器中混合气体的密度不再变化
D.混合气体的平均相对分子质量不再变化
E.
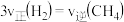
F.密闭容器内总压强不再变化
②若该反应达到化学平衡状态时,容器内气体的压强变为起始压强的1.6倍,则达平衡时
 的转化率为
的转化率为
您最近一年使用:0次
2022-04-18更新
|
256次组卷
|
2卷引用:湖北省新高考联考协作体2021-2022学年高一下学期期中考试化学试题



