名校
解题方法
1 . 苯及其同系物是一类重要的有机化工原料。
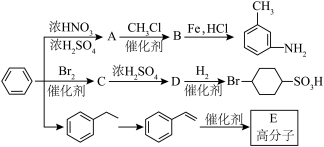
(1)B生成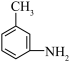 的反应类型为:
的反应类型为:________ ,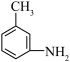 分子中最多有
分子中最多有________ 个原子共面。
(2)由 生成A温度控制在50~60℃,温度不宜过高或者过低,理由是
生成A温度控制在50~60℃,温度不宜过高或者过低,理由是________ 。
(3)已知: (R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为________ 。
(4)反应②的副产物D与A互为同分异构体,写出生成D结构简式:________ 。
(5)反应④的条件为________ 。
(6)邻氨基苯甲酸在一定条件下可发生取代反应,生成酰胺类化合物,请写出由两个邻氨基苯甲酸分子生成的环状酰胺类化合物的结构简式________ 。
已知:①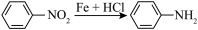 (苯胺,弱碱性,易被氧化)
(苯胺,弱碱性,易被氧化)
②苯的同系物能被酸性高锰酸钾氧化,如: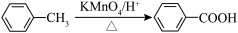
(1)B生成
 的反应类型为:
的反应类型为: 分子中最多有
分子中最多有(2)由
 生成A温度控制在50~60℃,温度不宜过高或者过低,理由是
生成A温度控制在50~60℃,温度不宜过高或者过低,理由是(3)已知:
 (R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为 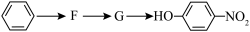
(4)反应②的副产物D与A互为同分异构体,写出生成D结构简式:
(5)反应④的条件为
(6)邻氨基苯甲酸在一定条件下可发生取代反应,生成酰胺类化合物,请写出由两个邻氨基苯甲酸分子生成的环状酰胺类化合物的结构简式
您最近一年使用:0次
名校
解题方法
2 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
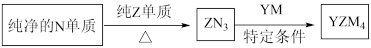
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
解题方法
3 . A、B、C、D、E、X是中学常见的无机物,存在如图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。

(1)若A为单质,且C为一种强酸,请回答以下问题:①组成单质A的元素在元素周期表中的位置为___________________ ;用电子式表示C 的形成过程____________________ 。
②A与H2O反应的离子反应方程式为______________________ 。
③X可能为_______________ (填代号)
a.NaOH b.AlCl3c.Na2CO3d.NaAlO 2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生,则:①B的电子式为_________________ 。
②A与H2O反应的化学反应方程式为_______________________ 。

(1)若A为单质,且C为一种强酸,请回答以下问题:①组成单质A的元素在元素周期表中的位置为
②A与H2O反应的离子反应方程式为
③X可能为
a.NaOH b.AlCl3c.Na2CO3d.NaAlO 2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生,则:①B的电子式为
②A与H2O反应的化学反应方程式为
您最近一年使用:0次
解题方法
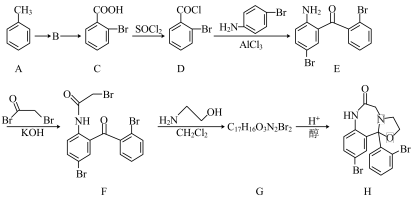
4 . 化合物H是一种抗失眠药物,其合成路线如下:
已知:一元取代苯进行二元取代反应时,已有基团会对其他基团进入苯环的位置产生影响。
如: 为邻、对位定位基,
为邻、对位定位基,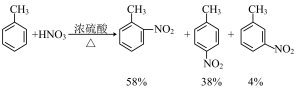 ,
, 为邻、对位定位基,
为邻、对位定位基,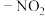 、
、 为间位定位基。
为间位定位基。
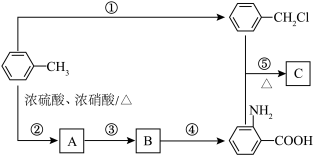
(1)B→C所需的试剂为___________ 。
(2)若用 代替
代替 ,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为
,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为___________ 。
(3)G→H转化过程中另一产物为____________ 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________ 。
①能发生银镜反应:②含有两个苯环,分子中有3种不同化学环境的氢原子。
(5)设计以乙二酸(HOOCCOOH)和苯为原料制备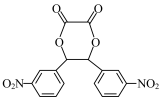 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干) ____________ 。

已知:一元取代苯进行二元取代反应时,已有基团会对其他基团进入苯环的位置产生影响。
如:
 为邻、对位定位基,
为邻、对位定位基, ,
, 为邻、对位定位基,
为邻、对位定位基, 、
、 为间位定位基。
为间位定位基。(1)B→C所需的试剂为
(2)若用
 代替
代替 ,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为
,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为(3)G→H转化过程中另一产物为
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①能发生银镜反应:②含有两个苯环,分子中有3种不同化学环境的氢原子。
(5)设计以乙二酸(HOOCCOOH)和苯为原料制备
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
您最近一年使用:0次
解题方法
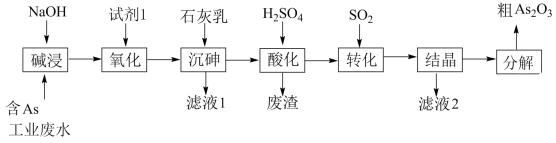
5 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
名校
解题方法
6 . 砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________ ,AsH3的电子式_________ 。
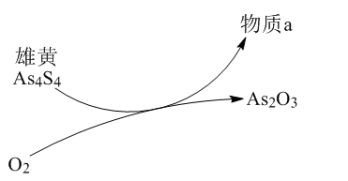
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________ (填化学式)。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) 2As(g) +3CO(g)
2As(g) +3CO(g) 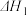 =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)
 As4(g) +3CO(g)
As4(g) +3CO(g) 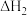 =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) 4As(g)
4As(g) 
①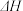 =
=_________ kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
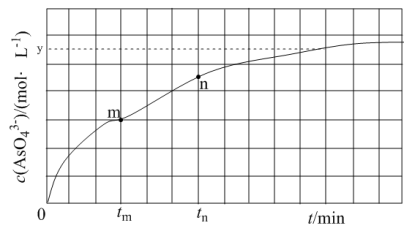
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v( )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c( )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正( )
)_______ (填“大于”“小于”或“等于”)v逆(  )。
)。
③tm min时,v逆( )
) _______ (填“大于”“小于”或“等于”)tn时v逆(  ),理由是
),理由是___________________ 。
(1)As在元素周期表中的位置是
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)
 2As(g) +3CO(g)
2As(g) +3CO(g) 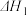 =a kJ· mol-1
=a kJ· mol-1反应 II.As2O3(g) +3C(s)

 As4(g) +3CO(g)
As4(g) +3CO(g) 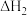 =b kJ ·mol-1
=b kJ ·mol-1反应III.As4(g)
 4As(g)
4As(g) 
①
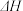 =
=②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III | ||
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
由表中数据判断催化剂X
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:
 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可说明反应达到平衡的是
a.v(I- ) =2v(
 )
) b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(
 )/c(
)/c( )不再发生变化
)不再发生变化e.c(Na+) =5xmol· L-1
②tm min时,v正(
 )
) )。
)。③tm min时,v逆(
 )
)  ),理由是
),理由是
您最近一年使用:0次
名校
7 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
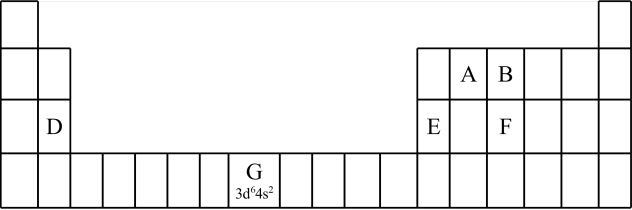
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号 、115号
、115号 、117号
、117号 、118号
、118号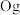 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
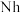 、115号
、115号 、117号
、117号 、118号
、118号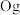 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
60次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
名校
8 . 2023年7月3日,商务部与海关总署发布公告,宣布对镓、锗相关物项实施出口管制。金属镓被称为“电子工业脊梁”,氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:

已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为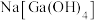 、
、 、
、 。
。
③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度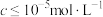 时,可认为已除尽。
时,可认为已除尽。

回答下列问题:
(1)基态Ga原子的核外电子排布式为___________ ,Br在元素周期表中的位置为___________ 。
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出 所发生反应的化学方程式为
所发生反应的化学方程式为___________ 。
(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是___________ (写化学式)。
(4)步骤①和②中通入过量气体A发生反应的离子方程式为___________ 。
(5)常温下,反应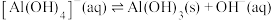 的平衡常数
的平衡常数
___________ 。
(6)以纯镓为原料可制得另一种半导体材料 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为___________ pm(列出计算式即可)。

 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:
已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为
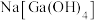 、
、 、
、 。
。③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度
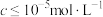 时,可认为已除尽。
时,可认为已除尽。
回答下列问题:
(1)基态Ga原子的核外电子排布式为
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出
 所发生反应的化学方程式为
所发生反应的化学方程式为(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是
(4)步骤①和②中通入过量气体A发生反应的离子方程式为
(5)常温下,反应
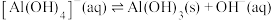 的平衡常数
的平衡常数
(6)以纯镓为原料可制得另一种半导体材料
 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为
您最近一年使用:0次
2024-01-07更新
|
248次组卷
|
2卷引用:2024届湖南省湘东九校联盟高三上学期第一次联考化学试题
解题方法
9 . 烯烃在有机合成中有重要作用,其反应机理及合成路线是化学研究的热点。回答下列问题:
Ⅰ.乙烯催化氧化的过程如图所示(部分相关离子未画出): 的作用是
的作用是___________ ,乙烯催化氧化反应的化学方程式为___________ 。
Ⅱ.苯乙烯在一定条件下有如图所示转化关系:___________ 。
(3)产物C可能的结构简式为___________ (任写一种)。
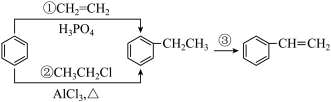
(4)以下是合成苯乙烯的一种路线:___________ ,写出反应②的化学方程式:___________
(5)已知: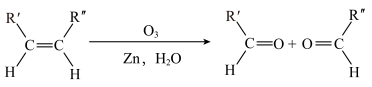 ,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为
,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为 的烯烃发生臭氧化反应最多有
的烯烃发生臭氧化反应最多有___________ 种产物。
Ⅰ.乙烯催化氧化的过程如图所示(部分相关离子未画出):
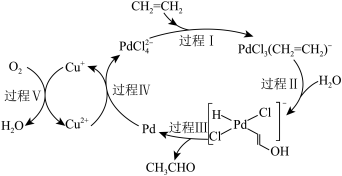
 的作用是
的作用是Ⅱ.苯乙烯在一定条件下有如图所示转化关系:
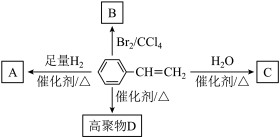
(3)产物C可能的结构简式为
(4)以下是合成苯乙烯的一种路线:
(5)已知:
 ,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为
,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为 的烯烃发生臭氧化反应最多有
的烯烃发生臭氧化反应最多有
您最近一年使用:0次
解题方法
10 . 铁、铜是人类较早使用的金属。请按要求回答下列问题:
(1)基态 原子的简化电子排布式为
原子的简化电子排布式为___________ ;铜位于元素周期表中的位置:___________ 。
(2)电子工业用 溶液腐蚀覆铜板上不需要的铜,制造印刷电路板,其反应原理的离子方程式为
溶液腐蚀覆铜板上不需要的铜,制造印刷电路板,其反应原理的离子方程式为___________ 。
(3)人体不易吸收三价铁,但易吸收二价铁,故常用硫酸亚铁晶体( )作补血剂。某课外小组的同学设计如图实验步骤,测定该补血剂中铁元素的含量。
)作补血剂。某课外小组的同学设计如图实验步骤,测定该补血剂中铁元素的含量。
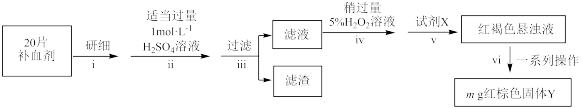
①补铁剂药用说明书上常标注“与维生素 同服效果更好”,其理由是
同服效果更好”,其理由是___________ 。
②步骤i,研细的目的是___________ 。
③为验证步骤iii滤液中含有 ,可采取的方案:
,可采取的方案:___________ 。步骤iv中加入 溶液的目的是:
溶液的目的是:___________ 。
④步骤v反应的离子方程式:___________ 。
⑤步骤vi一系列操作:过滤、洗涤、___________ 、冷却、称量。假设实验过程中铁元素全部转化到固体 中,则每片补血剂中含铁元素的质量为
中,则每片补血剂中含铁元素的质量为___________ 。
(4)青铜器在潮湿环境中发生电化学腐蚀的原理示意图如图:
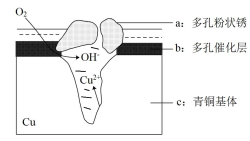
①腐蚀过程中,负极材料是(填图中字母“a”或“b”或“c”)___________ ;正极反应为___________ 。
②环境中的 扩散到孔口,与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,与正极反应产物和负极反应产物作用生成多孔粉状锈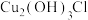 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
③若生成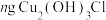 ,则理论上消耗标准状况下氧气体积为(写初始数据表达式,均带各自物理量单位)
,则理论上消耗标准状况下氧气体积为(写初始数据表达式,均带各自物理量单位)___________ 。
(1)基态
 原子的简化电子排布式为
原子的简化电子排布式为(2)电子工业用
 溶液腐蚀覆铜板上不需要的铜,制造印刷电路板,其反应原理的离子方程式为
溶液腐蚀覆铜板上不需要的铜,制造印刷电路板,其反应原理的离子方程式为(3)人体不易吸收三价铁,但易吸收二价铁,故常用硫酸亚铁晶体(
 )作补血剂。某课外小组的同学设计如图实验步骤,测定该补血剂中铁元素的含量。
)作补血剂。某课外小组的同学设计如图实验步骤,测定该补血剂中铁元素的含量。
①补铁剂药用说明书上常标注“与维生素
 同服效果更好”,其理由是
同服效果更好”,其理由是②步骤i,研细的目的是
③为验证步骤iii滤液中含有
 ,可采取的方案:
,可采取的方案: 溶液的目的是:
溶液的目的是:④步骤v反应的离子方程式:
⑤步骤vi一系列操作:过滤、洗涤、
 中,则每片补血剂中含铁元素的质量为
中,则每片补血剂中含铁元素的质量为(4)青铜器在潮湿环境中发生电化学腐蚀的原理示意图如图:

①腐蚀过程中,负极材料是(填图中字母“a”或“b”或“c”)
②环境中的
 扩散到孔口,与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,与正极反应产物和负极反应产物作用生成多孔粉状锈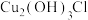 ,写出该反应的离子方程式:
,写出该反应的离子方程式:③若生成
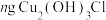 ,则理论上消耗标准状况下氧气体积为(写初始数据表达式,均带各自物理量单位)
,则理论上消耗标准状况下氧气体积为(写初始数据表达式,均带各自物理量单位)
您最近一年使用:0次



