解题方法
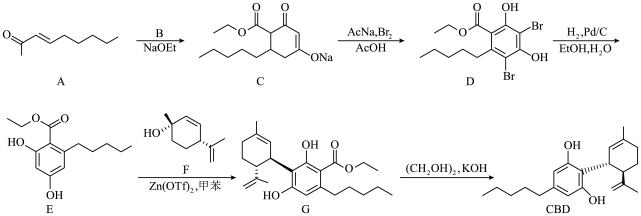
1 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为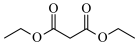 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
(5)已知:R-CN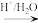 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成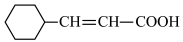 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
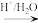 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成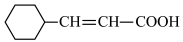 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近一年使用:0次
2 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: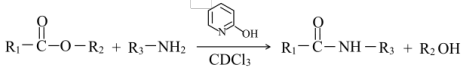 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
名校
解题方法
3 . 有机物K合成路线如下图 (部分条件已省略)。

已知:
①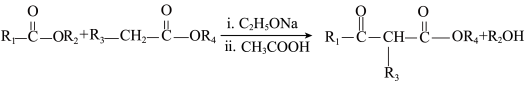
②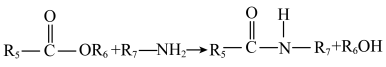 (
( 表示烃基)。
表示烃基)。
请回答下列问题。
(1)K的分子式为_______ 。
(2)A中官能团的名称是_______ ,G→H的反应类型是_______ 。
(3)B→D的化学方程式为_______ 。
(4)F→G中NaOH的作用是_______ 。
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:_______ 。(元素电负性:H-2.1 C-2.5 O-3.5)
(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为_______ 。
②Q和K是互变异构关系,K比Q稳定的原因是_______ 。
(7)X是D的同分异构体,符合下列条件的X的结构简式是_______ 。
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

已知:
①
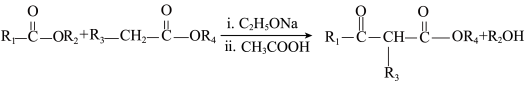
②
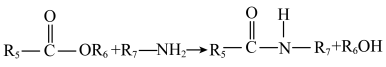 (
( 表示烃基)。
表示烃基)。请回答下列问题。
(1)K的分子式为
(2)A中官能团的名称是
(3)B→D的化学方程式为
(4)F→G中NaOH的作用是
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和
 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为
②Q和K是互变异构关系,K比Q稳定的原因是
(7)X是D的同分异构体,符合下列条件的X的结构简式是
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3
您最近一年使用:0次
名校
解题方法
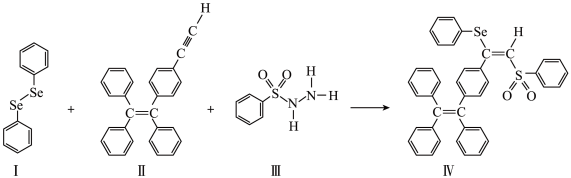
4 . 硒(Se是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子的合成路线如下:
(1)基态硒原子的价电子排布式为_______ 。
(2)比较沸点
_______  (填“>”或“<”),并解释原因
(填“>”或“<”),并解释原因_______ 。
(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
(4) 分子Ⅲ的价电子中,有
分子Ⅲ的价电子中,有_______ mol孤电子对。
(5)适量的硒酸钠 可减轻重金属铊引起的中毒,
可减轻重金属铊引起的中毒, 的立体构型为
的立体构型为____ 。结合无机含氧酸的酸性变化规律,比较酸性:
_____  (填“>”或“<”)。
(填“>”或“<”)。
(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。_______ 个。
②该晶胞参数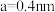 、
、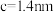 ,该晶体密度
,该晶体密度
_______  。(用
。(用 表示阿伏加德罗常数,写出计算表达式即可)
表示阿伏加德罗常数,写出计算表达式即可)
(1)基态硒原子的价电子排布式为
(2)比较沸点

 (填“>”或“<”),并解释原因
(填“>”或“<”),并解释原因(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
A.Ⅰ中Se原子为 杂化,碳原子不都是 杂化,碳原子不都是 杂化 杂化 |
| B.Ⅱ是由极性键和非极性键组成的弱极性分子 |
| C.Ⅲ含有的所有元素中,O的电负性最大 |
| D.Ⅳ中含有2个手性碳原子 |
(4)
 分子Ⅲ的价电子中,有
分子Ⅲ的价电子中,有(5)适量的硒酸钠
 可减轻重金属铊引起的中毒,
可减轻重金属铊引起的中毒, 的立体构型为
的立体构型为
 (填“>”或“<”)。
(填“>”或“<”)。(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
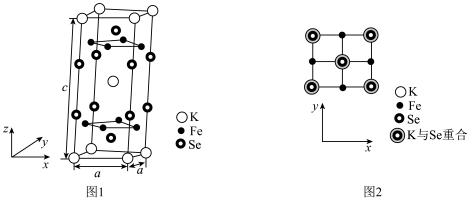
②该晶胞参数
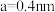 、
、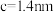 ,该晶体密度
,该晶体密度
 。(用
。(用 表示阿伏加德罗常数,写出计算表达式即可)
表示阿伏加德罗常数,写出计算表达式即可)
您最近一年使用:0次
名校
解题方法
5 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,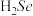 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
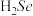 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。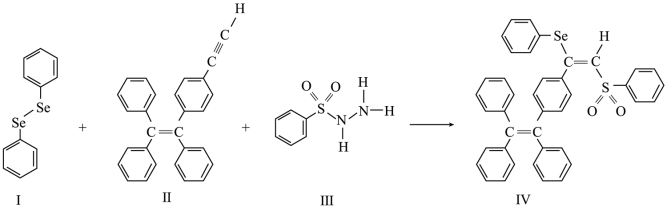
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近一年使用:0次
名校
6 . 三苯胺及其衍生物可用于新型电致发光材料、特种染料和医药的合成,一种三苯胺单醛的修饰路线如图所示,下列说法错误的是

| A.电负性:H<C<O | B.甲中所有碳原子一定在同一平面 |
| C.乙的核磁共振氢谱有7组峰 | D.该反应发生了 键的断裂 键的断裂 |
您最近一年使用:0次
解题方法
7 . 化合物F是一种重要的有机合成中间体,某研究小组按下列路线进行合成:
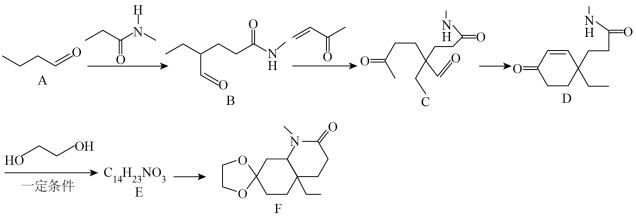
已知: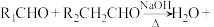
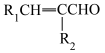
请回答下列问题:
(1)有机物B所含的官能团名称是___________ ,B→C的反应类型为___________ 。
(2)化合物E的结构简式是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)1分子有机物F分子中含有的手性碳原子数为___________ 。
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为___________ ,第一电离能最大的为___________ (填元素符号)。
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:___________ (任写一种)。
①IR谱检测表明:分子中含有一个苯环,有 键,无
键,无 、
、 键。
键。
② 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。
③仅含有两种官能团,其中一种为 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。

已知:
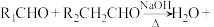
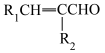
请回答下列问题:
(1)有机物B所含的官能团名称是
(2)化合物E的结构简式是
(3)写出D→E的化学方程式:
(4)1分子有机物F分子中含有的手性碳原子数为
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:
①IR谱检测表明:分子中含有一个苯环,有
 键,无
键,无 、
、 键。
键。②
 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。③仅含有两种官能团,其中一种为
 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。
您最近一年使用:0次
名校
8 . 铁、钴、镍三种元素位于元素周期表中第4周期第Ⅷ族,通常将铁钴镍三种元素称为铁系元素,请回答:
(1)基态镍原子的价层电子排布式___________
(2)已知无水三氯化铁熔点为307.6℃,沸点约为306℃,可以升华,400℃以下的气态氯化铁主要通过配位键以二聚体形式存在,据此判断氯化铁的晶体类型___________ ,氯化铁二聚体的结构式是___________
(3)铁系元素易通过配位键形成各种多环系化合物,钴酞菁是其中的一种。图1是酞菁和钴酞菁的分子结构,酞菁分子中所有原子共平面,下列说法正确的是___________

(4)邻苯二甲酸酐(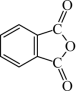 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(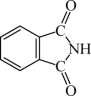 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是___________ 。
(5)下图为一种常见锂离子电池电极材料的六棱柱结构单元及其沿垂直底面方向的投影图,其底面是正六边形 。
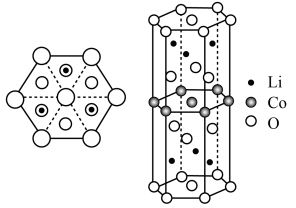
①该电极材料物质的化学式为___________ 。
②该晶体中Li原子周围距离最近且相等的O原子有___________ 个。
(1)基态镍原子的价层电子排布式
(2)已知无水三氯化铁熔点为307.6℃,沸点约为306℃,可以升华,400℃以下的气态氯化铁主要通过配位键以二聚体形式存在,据此判断氯化铁的晶体类型
(3)铁系元素易通过配位键形成各种多环系化合物,钴酞菁是其中的一种。图1是酞菁和钴酞菁的分子结构,酞菁分子中所有原子共平面,下列说法正确的是___________

| A.标注①②的N原子的杂化方式是sp2,③的N原子的杂化方式sp3 |
| B.钴酞菁中元素的电负性由大到小顺序为:N>C>H>Co |
| C.钴酞菁中钴元素的化合价是+2 |
| D.钴酞菁中的作用力有:离子键、氢键、配位键、π键、σ键 |
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是(5)下图为一种常见锂离子电池电极材料的六棱柱结构单元及其沿垂直底面方向的投影图,其底面是

①该电极材料物质的化学式为
②该晶体中Li原子周围距离最近且相等的O原子有
您最近一年使用:0次
9 . I由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(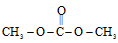 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:

(1)O原子的核外有____ 种空间运动状态的电子。碳酸二甲酯中非金属元素的电负性从大到小的顺序为____ 。
(2)尿素中N的第一电离能比O的高,原因是:
①N的p轨道电子排布是半充满的,比较稳定,电离能高;
②____ 。
(3)下列说法不正确 的是____ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
(4)碳酸二甲酯在碱性条件下水解可产生甲醇和碳酸盐,水解产物中CO 的空间构型为
的空间构型为____ 。已知大π键可以用π 表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,(如苯分子中的大π键可表示为π
表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,(如苯分子中的大π键可表示为π ),则CO
),则CO 中的大π键应表示为
中的大π键应表示为____ 。
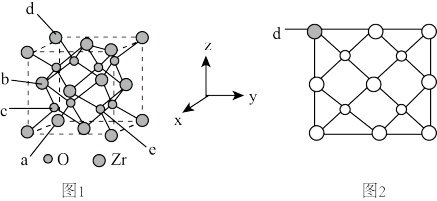
II.在CeO2-ZrO2固溶体的催化体系中也能将CO2转化为碳酸二甲酯。
(5)氧化锆(化学式为ZrO2)晶胞结构如图1所示,若以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。以a点为原点,按如图所示方向建立直角坐标系,若a、b点微粒的分数坐标分别为(0,0,0),( ,0,
,0, ),则c点微粒的分数坐标为
),则c点微粒的分数坐标为____ 。晶胞沿z轴方向在xy平面的投影平面图如图2,如:d点的投影如图2中涂黑的部分,请在图2中涂黑标并注b和e点微粒的位置____ 。
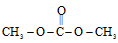 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)O原子的核外有
(2)尿素中N的第一电离能比O的高,原因是:
①N的p轨道电子排布是半充满的,比较稳定,电离能高;
②
(3)下列说法
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
(4)碳酸二甲酯在碱性条件下水解可产生甲醇和碳酸盐,水解产物中CO
 的空间构型为
的空间构型为 表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,(如苯分子中的大π键可表示为π
表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,(如苯分子中的大π键可表示为π ),则CO
),则CO 中的大π键应表示为
中的大π键应表示为II.在CeO2-ZrO2固溶体的催化体系中也能将CO2转化为碳酸二甲酯。
(5)氧化锆(化学式为ZrO2)晶胞结构如图1所示,若以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。以a点为原点,按如图所示方向建立直角坐标系,若a、b点微粒的分数坐标分别为(0,0,0),(
 ,0,
,0, ),则c点微粒的分数坐标为
),则c点微粒的分数坐标为
您最近一年使用:0次
名校
解题方法
10 . 研究人员利用3,3-二氟环丁基胺,成功设计并合成出了首例无铅、多极轴的二维有机—无机杂化钙钛矿铁电体{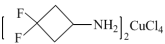 }。该材料表现出了优异的铁电性能、出色的多极轴特性和独特的热致变色性质,有望应用于新一代的多功能智能器件中。请回答下列问题:
}。该材料表现出了优异的铁电性能、出色的多极轴特性和独特的热致变色性质,有望应用于新一代的多功能智能器件中。请回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为_______ 。
(2)3,3-二氟环丁基胺(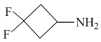 )中所含元素的电负性由强到弱的顺序为
)中所含元素的电负性由强到弱的顺序为_______ (用元素符号表示)。
(3)沸点:
_______ (填“>”或“<”) ,解释其原因:
,解释其原因:_______ 。
(4) 配合物中碳原子的杂化类型是
配合物中碳原子的杂化类型是_______ ,所含化学键的类型为_______ 。
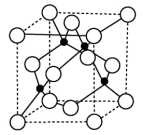
(5)单质铁的晶体在不同温度下有两种堆积方式,分别为面心立方最密堆积和体心立方堆积。则在面心立方晶胞和体心立方晶胞中含有的铁原子的个数之比为_______ 。
(6)晶体具有自范性及各向异性等特点,造成晶体某些物理性质的各向异性最本质的原因是_______ ;铜与氯形成的晶体的晶胞如图所示,该晶体的化学式为_______ ,已知晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。
。
 }。该材料表现出了优异的铁电性能、出色的多极轴特性和独特的热致变色性质,有望应用于新一代的多功能智能器件中。请回答下列问题:
}。该材料表现出了优异的铁电性能、出色的多极轴特性和独特的热致变色性质,有望应用于新一代的多功能智能器件中。请回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为(2)3,3-二氟环丁基胺(
 )中所含元素的电负性由强到弱的顺序为
)中所含元素的电负性由强到弱的顺序为(3)沸点:

 ,解释其原因:
,解释其原因:(4)
 配合物中碳原子的杂化类型是
配合物中碳原子的杂化类型是(5)单质铁的晶体在不同温度下有两种堆积方式,分别为面心立方最密堆积和体心立方堆积。则在面心立方晶胞和体心立方晶胞中含有的铁原子的个数之比为
(6)晶体具有自范性及各向异性等特点,造成晶体某些物理性质的各向异性最本质的原因是
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2021-09-09更新
|
212次组卷
|
3卷引用:重庆市2021年9月高三上学期入学诊断考试化学试题