解题方法
1 . X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____ 族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____ 。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______ ,如果司机酒驾检查时该物质显示的颜色变化是_____________________ 。
(2)关于R单质晶体的说法正确的是______________ 。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC•••‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
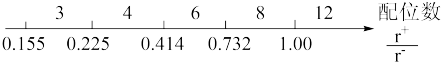
已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______ 晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________ 。
(4)W的原子半径为r,其晶体的空间利用率______________ (用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________ 。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______ ,中心原子的杂化方式为_____
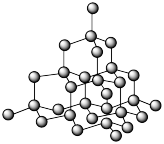
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________ 个。
(1)Q元素位于周期表第
(2)关于R单质晶体的说法正确的是
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC•••‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
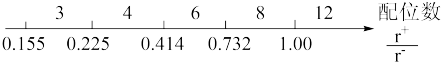
已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见
(4)W的原子半径为r,其晶体的空间利用率
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是

您最近一年使用:0次
2011·陕西西安·三模
解题方法
2 . A、B、C、D、E、F、G、H八种元素都是前4周期元素,且原子序数依次增大。已知:元素A的原子中没有成对电子。元素B、C、D同周期,元素B、G同主族,且B、D、G三原子P轨道上均有2个未成对电子元素E、F、G在同一周期,且E原子中没有未成对电子。元素H的基态原子核外有6个未成对电子。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为_______ (用元素符号表示);E、F、G三元素的原子的第一电离能由大到小排列顺序为_______ (用元素符号表示)。
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为___ (填化学式),其原因是_________ 。
(3)元素B与C的气态氢化物在A B中溶解性由大到小的顺序为
B中溶解性由大到小的顺序为___ (填化学式),其原因是________ 。
(4)B、D两元素形成的阴离子BD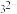 中的B的杂化类型为
中的B的杂化类型为______ ,空间结构为______ ,与BD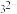 互为等电子体且含C、D两元素的微粒的化学式为
互为等电子体且含C、D两元素的微粒的化学式为______ 。
(5)A、B、C三元素各一个原子形成的分子中 键与
键与 键的个数比为
键的个数比为______ ,该分子的VSERR模型______ 。
(6)元素H的基态原子的核外电子排布为_______ ,在周期表中处于_____ 区。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为
(3)元素B与C的气态氢化物在A
 B中溶解性由大到小的顺序为
B中溶解性由大到小的顺序为(4)B、D两元素形成的阴离子BD
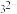 中的B的杂化类型为
中的B的杂化类型为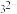 互为等电子体且含C、D两元素的微粒的化学式为
互为等电子体且含C、D两元素的微粒的化学式为(5)A、B、C三元素各一个原子形成的分子中
 键与
键与 键的个数比为
键的个数比为(6)元素H的基态原子的核外电子排布为
您最近一年使用:0次



