解题方法
1 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
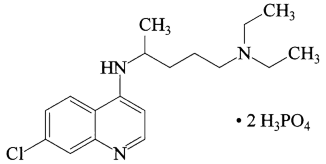
(1)基态P原子中,电子占据的最高能级符号为___ ,基态N原子核外有__ 种运动状态不同的电子。
(2)C、N、O三种元素电负性从大到小的顺序为___ ;第一电离能χ(P)__ χ(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为__ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___ 。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
①GaN、GaP、GaAs的熔点变化原因是___ 。
②砷化镓晶体中含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
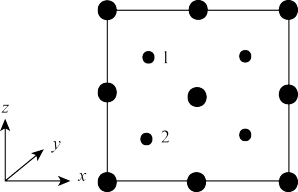
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为___ ;若磷化镓的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___ pm(用代数式表示)。

(1)基态P原子中,电子占据的最高能级符号为
(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
| GaN | GaP | GaAs | |
| 熔点/℃ | 1700 | 1480 | 1238 |
②砷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为

您最近一年使用:0次
2021-05-03更新
|
224次组卷
|
2卷引用:陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题
名校
解题方法
2 . LiFePO4、聚乙二醇、LiPF6、LiAsF6、LiCl等常用作锂离子聚合物电池的材料和载体。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为___________ 。
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为___________ 。
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有________ 。
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(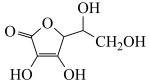 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是____________________ ,该分子中碳原子的杂化方式为___________ 。
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
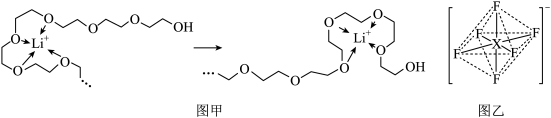
①从化学键角度看,Li+迁移过程发生___________ (填“物理变化”或“化学变化”)。
②相同条件,Li+在___________ (选填“LiPF6”或“LiAsF6”)中迁移较快,原因是___________ 。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。
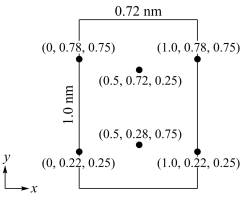
①该晶胞中Cl原子的数目为___________ 。
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为___ g·cm-3(列出计算表达式)。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。

①该晶胞中Cl原子的数目为
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为
您最近一年使用:0次
名校
解题方法
3 . 铜及其化合物在很多领域有重要的用途,如氧化亚铜(Cu2O)可做半导体材料,胆矾(CuSO4·5H2O)用于杀菌剂,磷酸氧铜[Cu4O(PO4)2]能充当电极的活性物质。请回答下列相关问题。
(1)写出基态Cu+离子的核外电子排布式____________________ ,与Cu同周期且与Cu原子最外层电子数相等的元素有______________________ (填元素符号)。
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为______________________ 。
(3)PO43-的VSEPR模型为______________________ ,中心原子P的杂化类型为___________ ,与其互为等电子体的离子有______________________ (写出两种)。
(4)胆矾(CuSO4• 5H2O)的结构示意图如下图,请结合示意图完成下列问题。
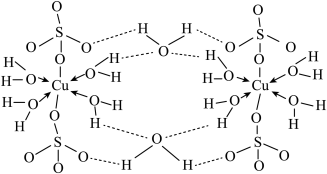

①将胆矾的化学式写成配合物的形式为______________________ 。
②胆矾中含有的微粒间作用力有______________________ (填序号)。
a.离子键b.极性键c.金属键d.配位键e.氢键f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的__________ (填“高”或“低”),原因是____________________ 。
②CuO的晶胞结构如上图所示,O2-的配位数是__________ 。
(1)写出基态Cu+离子的核外电子排布式
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为
(3)PO43-的VSEPR模型为
(4)胆矾(CuSO4• 5H2O)的结构示意图如下图,请结合示意图完成下列问题。


①将胆矾的化学式写成配合物的形式为
②胆矾中含有的微粒间作用力有
a.离子键b.极性键c.金属键d.配位键e.氢键f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的
②CuO的晶胞结构如上图所示,O2-的配位数是
您最近一年使用:0次
4 .
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________ (写化学式)
(2)基态Cr3+的核外电子排布式为_____________________ 。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________ ,C2O42-中碳原子的杂化轨道类型是___________ ,与H2O互为等电子体的离子是___________ (任写一种)
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________ (填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________ 。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________ pm。
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为___________ g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________ pm。
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是
(2)基态Cr3+的核外电子排布式为
(3)配合物K[Cr(C2O4)2(H2O)中的配体是
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为
您最近一年使用:0次
2018-12-13更新
|
410次组卷
|
3卷引用:陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题



