1 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、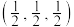 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、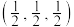 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近半年使用:0次
解题方法
2 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近半年使用:0次
3 . 镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
(3)一种由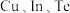 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。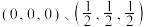 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
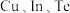 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
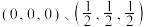 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近半年使用:0次
名校
解题方法
4 . 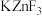 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、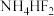 制备。回答下列问题:
制备。回答下列问题:
(1)基态Zn原子的价电子轨道表达式为___________ ;基态N原子中未成对电子数为___________ 。
(2)O的第一电离能小于N的第一电离能的原因是___________ ;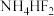 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为___________ (用元素符号表示)。
(3) 中阴离子的空间构型为
中阴离子的空间构型为___________ ;其中C原子的杂化方式为___________ 。
(4) 具有金红石型四方结构,
具有金红石型四方结构,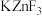 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
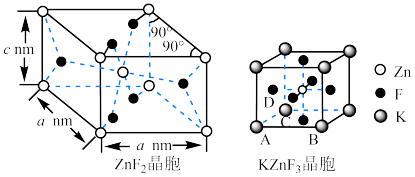
① 和
和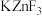 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为___________ 。
②若 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
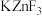 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、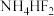 制备。回答下列问题:
制备。回答下列问题:(1)基态Zn原子的价电子轨道表达式为
(2)O的第一电离能小于N的第一电离能的原因是
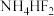 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为(3)
 中阴离子的空间构型为
中阴离子的空间构型为(4)
 具有金红石型四方结构,
具有金红石型四方结构,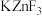 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
①
 和
和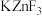 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为②若
 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2024-01-08更新
|
230次组卷
|
2卷引用:2024届陕西省商洛市高三上学期尖子生学情诊断考试理综试题
名校
解题方法
5 . 工业上利用镁精矿石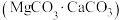 可以制备单质Mg,其反应原理为
可以制备单质Mg,其反应原理为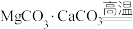
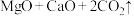 、
、 。请回答下列问题:
。请回答下列问题:
(1)基态硅原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为______ ;上述反应原理中所涉及的非金属元素的电负性从大到小的顺序为______ (用元素符号表示)。
(2)钙或钙盐的焰色为砖红色,该光谱属于______ 光谱(填“吸收”或“发射”)。
(3)单质镁、单质硅的晶体类型依次为______ 、______ 。
(4)排放出的二氧化碳可用碳酸酐酶固定,碳酸酐酶的部分结构如图所示:
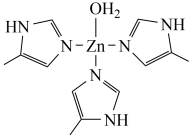
已知: 为平面形分子。
为平面形分子。
①上述碳酸酐酶的部分结构中氮原子、氧原子的杂化类型依次为______ 、______ 。
②1mol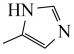 分子中含有
分子中含有______ 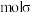 键。
键。
(5)MgO具有NaCl型结构,X射线衍射实验测得MgO晶胞边长为anm。

设 为阿伏加德罗常数的值,则MgO晶体的密度为
为阿伏加德罗常数的值,则MgO晶体的密度为______  ((用含a、
((用含a、 的代数式表示)。
的代数式表示)。
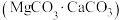 可以制备单质Mg,其反应原理为
可以制备单质Mg,其反应原理为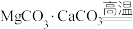
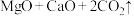 、
、 。请回答下列问题:
。请回答下列问题:(1)基态硅原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为
(2)钙或钙盐的焰色为砖红色,该光谱属于
(3)单质镁、单质硅的晶体类型依次为
(4)排放出的二氧化碳可用碳酸酐酶固定,碳酸酐酶的部分结构如图所示:

已知:
 为平面形分子。
为平面形分子。①上述碳酸酐酶的部分结构中氮原子、氧原子的杂化类型依次为
②1mol
 分子中含有
分子中含有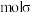 键。
键。(5)MgO具有NaCl型结构,X射线衍射实验测得MgO晶胞边长为anm。

设
 为阿伏加德罗常数的值,则MgO晶体的密度为
为阿伏加德罗常数的值,则MgO晶体的密度为 ((用含a、
((用含a、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2023-12-13更新
|
313次组卷
|
3卷引用:陕西省安康市高新中学2023-2024学年高三上学期阶段性测试四化学试题
名校
解题方法
6 . 铬是重要的金属元素之一,其化合物有着广泛的用途。
(1)基态铬原子的核外有________ 种空间运动状态不同的电子。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是_______ (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是_______ (填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:

①阴离子中碳原子的杂化轨道类型是_______ 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是________ 。
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
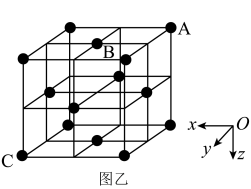
①下列为晶胞中Cr原子沿x轴方向的投影的是________ (填字母)。
a.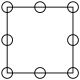 b.
b. c.
c. d.
d.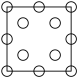
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B( ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是________ ,该原子到C原子的距离是_______ nm(用含a、b的代数式表示)。
(1)基态铬原子的核外有
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:

①阴离子中碳原子的杂化轨道类型是
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:

①下列为晶胞中Cr原子沿x轴方向的投影的是
a.
 b.
b. c.
c. d.
d.
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B(
 ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是
您最近半年使用:0次
7 . 氮的化合物在工业生产中有重要用途,请回答下列问题:
(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式);实验数据表明键角:NH3>PH3>AsH3,分析原因是_______ 。
(2)氮与碳还能形成一种离子液体的正离子 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是_______ 。
(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:
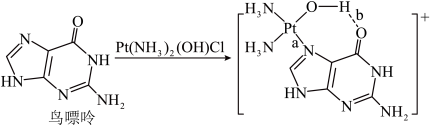
①基态Cu原子价层电子的轨道表示式为_______ ,鸟嘌呤中氮原子的杂化方式为______ 。构成鸟嘌呤的元素电负性由大到小的顺序_______ 。
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-_______ NH3(填“>”或“<”)。
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
请从分子结构角度解释顺铂在水中的溶解度大于反铂的原因是________ 。
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=_______ m3/mol(阿伏加德罗常数为NA)。(已知:单位物质的量的物质所具有的体积叫做摩尔体积)

(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N
 互为等电子体的分子:
互为等电子体的分子:(2)氮与碳还能形成一种离子液体的正离子
 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:

①基态Cu原子价层电子的轨道表示式为
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
| 顺铂 | 反铂 | |
| 结构 |  | 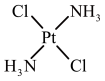 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=

您最近半年使用:0次
8 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
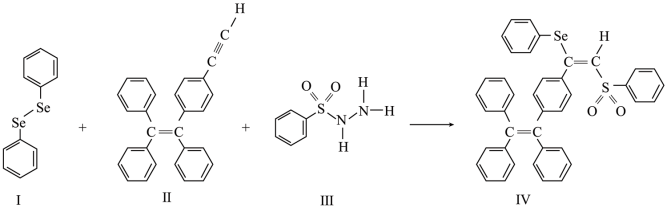
回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2)H2Se的沸点低于H2O,其原因是_____ 。
(3)关于I~Ⅲ三种反应物,下列说法正确的有_____ (填字母)。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_____ (填元素符号)。
(5)硒的两种含氧酸的酸性强弱为H2SeO4_____ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO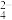 的立体构型为
的立体构型为_____ 。
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
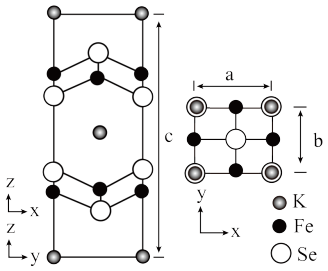
①该超导材料的最简化学式为_____ 。
②Fe原子的配位数为_____ 。
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_____ g•cm-3(列出计算式)。

回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于I~Ⅲ三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为H2SeO4
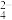 的立体构型为
的立体构型为(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为
您最近半年使用:0次
9 . 光刻技术需要利用深紫激光,我国是唯掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体KBBF(KBe2BO3F2), 实验室可用BeO、KBF4 和B2O3在700°C左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中K原子已经给出,氧原子略去),并放出BF3气体。
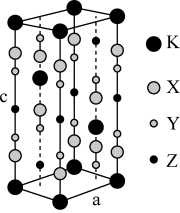
回答下列问题:
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________________ 。
(2)BF3的中心原子的杂化方式为_____________ ,与其互为等电子体的阴离子为__________ (填一种即可)。
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为__________ 。
(4)KBF4的阴离子空间构型为_________ 。
(5)三卤化硼的性质如下:
BF3、BCl3、 BBr3、BI3的沸点逐渐升高的原因是:________________________________ 。
(6)指出图中代表硼原子的字母为_________ ,该KBBF晶体的晶胞参数分别为apm和cpm, α=β=γ=90°, 则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏伽德罗常数的值,列出计算式)。

回答下列问题:
(1)基态钾原子的核外电子排布式为
(2)BF3的中心原子的杂化方式为
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4的阴离子空间构型为
(5)三卤化硼的性质如下:
BF3 | BCl3 | BBr3 | BI3 | |
熔点/°C | -127 | -107 | -46 | 49.9 |
沸点/°C | -99 | 12.5 | 91.3 | 210 |
(6)指出图中代表硼原子的字母为
您最近半年使用:0次
名校
10 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近半年使用:0次
2023-04-14更新
|
490次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



