1 .
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________ (写化学式)
(2)基态Cr3+的核外电子排布式为_____________________ 。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________ ,C2O42-中碳原子的杂化轨道类型是___________ ,与H2O互为等电子体的离子是___________ (任写一种)
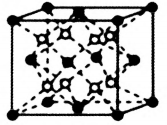
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________ (填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________ 。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________ pm。
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为___________ g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________ pm。
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是
(2)基态Cr3+的核外电子排布式为
(3)配合物K[Cr(C2O4)2(H2O)中的配体是
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为
您最近一年使用:0次
2018-12-13更新
|
410次组卷
|
3卷引用:陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题
解题方法
2 . 铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________ ,占据最高能级的电子的电子云轮廓图形状为___________ ,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________ 。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________ 。
(3)AlF3具有较高的熔点(1040℃),属于___________ 晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________ 。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________ ,该阴离子中存在的化学键有___________ (填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________ 。立方体边长为acm,阿伏伽德罗常数的值为NA,则CaF2晶体的密度为___________ g·cm-3(列出计算式)
(1)基态铝原子的核外电子排布式为
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式
(3)AlF3具有较高的熔点(1040℃),属于
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为

您最近一年使用:0次
2018-12-05更新
|
651次组卷
|
3卷引用:陕西省西安市2019届高三化学试题
名校
解题方法
3 . 氯磺酰氰酯(结构简式为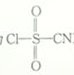 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是
(3)ClO4-的空间构型为
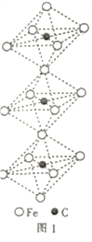
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为
您最近一年使用:0次
2018-05-25更新
|
262次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第五次模拟检测理综试题-高中化学
解题方法
4 . X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____ 族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____ 。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______ ,如果司机酒驾检查时该物质显示的颜色变化是_____________________ 。
(2)关于R单质晶体的说法正确的是______________ 。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC•••‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
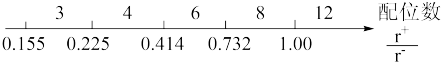
已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______ 晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________ 。
(4)W的原子半径为r,其晶体的空间利用率______________ (用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________ 。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______ ,中心原子的杂化方式为_____
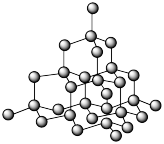
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________ 个。
(1)Q元素位于周期表第
(2)关于R单质晶体的说法正确的是
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC•••‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
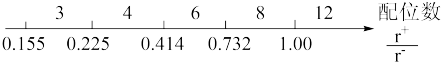
已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见
(4)W的原子半径为r,其晶体的空间利用率
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是

您最近一年使用:0次
5 . 铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)请写出铜的基态原子核外电子排布式:___________ 。
(2)铜的熔点比钙的高,其原因是____________ 。
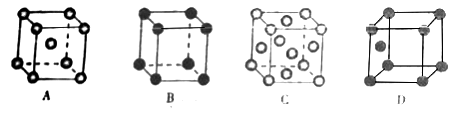
(3)金属铜的堆积方式为下图中的______ (填字母序号)。
(4)科学家通过 X 射线推测,胆矾的结构如下图所示。
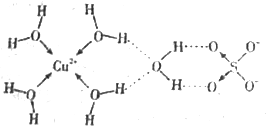
胆矾的阳离子中心原子的配位数为______ ,阴离子的空间构型为_______ 。胆矾中所含元素的电负性从大到小的顺序为_________ (用元素符号作答)。
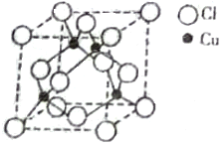
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为______ ,已知该晶体的密度为 4.14g/cm3,则该晶胞的边长为_______ pm(写计算式)。将该物质气化后实验测定其蒸汽的相对分子质量为 198,则其气体的分子式为_________ 。
(1)请写出铜的基态原子核外电子排布式:
(2)铜的熔点比钙的高,其原因是
(3)金属铜的堆积方式为下图中的

(4)科学家通过 X 射线推测,胆矾的结构如下图所示。

胆矾的阳离子中心原子的配位数为
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为

您最近一年使用:0次
解题方法
6 . CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________ ,其中未成对电子数为____________ 。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________ 。ZnGeAs2中 Zn、Ge、As 的电负性从大到小的顺序为________________ 。
(3) 聚吡咯的单体为吡咯( ),该分子中氮原子的杂化轨道类型为
),该分子中氮原子的杂化轨道类型为__________ ;分子中σ键与π键的数目之比为________________ 。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
分析熔点变化规律及其差异的原因:__________________________________________________ 。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
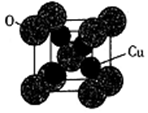
①氧化亚铜属于__________ 晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3 (列出计算式即可)。
(1)基态铬原子的核外电子排布式为
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为
(3) 聚吡咯的单体为吡咯(
 ),该分子中氮原子的杂化轨道类型为
),该分子中氮原子的杂化轨道类型为(4)碳化硅、晶体硅及金刚石的熔点如下表:
| 立方碳化硅 | 晶体硅 | 金刚石 | |
| 熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。

①氧化亚铜属于
②已知Cu2O的晶胞参数a=425.8pm,则其密度为
您最近一年使用:0次
7 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
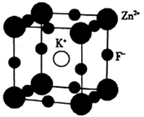
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:陕西省榆林市2018届高三第二次模拟考试理综化学试题
8 . [2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________ ,有__________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________ 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________ ,微粒之间存在的作用力是_______________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______________ 。_____ g·cm−3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为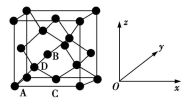
您最近一年使用:0次
2016-12-09更新
|
7008次组卷
|
32卷引用:陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题
陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题陕西省武功县2021-2022学年高三上学期第二次质量检测理科综合化学试题 2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题2017届山东省潍坊市实验中学高三下学期第四次单元过关测试理科综合化学试卷云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省玉溪市峨山一中2019届高三9月上学期月考化学试题云南省玉溪市新平县第一中学2019届高三第一次月考理综化学试题云南省新平一中2019届高三上学期12月考试化学试题2016年全国普通高等学校招生统一考试化学(全国1卷参考版)广东省深圳外国语学校2019届高三第一次月考理综化学试题鲁科版高中化学选修3模块综合测评卷新疆乌鲁木齐县柴窝堡林场中学2019届高三四月调研考试理综化学试题百所名校联考-物质结构与性质云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题广东省深圳市罗湖区2022届高三上学期第一次质量检测化学试题贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题湖南省岳阳市汨罗市第二中学2022届高三下学期期中考试化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷
2013·陕西延安·一模
名校
解题方法
9 . 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
(1)镓的基态原子的电子排布式是_________________ 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___________ ,与同一个镓原子相连的砷原子构成的空间构型为______________ 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是________ 。 (用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________ 。
(5)比较二者的第一电离能:As______ Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是_____________(填字母)。

(1)镓的基态原子的电子排布式是
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为
(5)比较二者的第一电离能:As
(6)下列说法正确的是_____________(填字母)。
| A.砷化镓晶胞结构与NaCl相同 | B.GaP与GaAs互为等电子体 |
| C.电负性:As>Ga | D.砷化镓晶体中含有配位键 |
您最近一年使用:0次
2016-12-09更新
|
994次组卷
|
3卷引用:2013届陕西省延安市秋高考模拟理综化学试卷
(已下线)2013届陕西省延安市秋高考模拟理综化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题
2011·陕西西安·三模
解题方法
10 . A、B、C、D、E、F、G、H八种元素都是前4周期元素,且原子序数依次增大。已知:元素A的原子中没有成对电子。元素B、C、D同周期,元素B、G同主族,且B、D、G三原子P轨道上均有2个未成对电子元素E、F、G在同一周期,且E原子中没有未成对电子。元素H的基态原子核外有6个未成对电子。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为_______ (用元素符号表示);E、F、G三元素的原子的第一电离能由大到小排列顺序为_______ (用元素符号表示)。
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为___ (填化学式),其原因是_________ 。
(3)元素B与C的气态氢化物在A B中溶解性由大到小的顺序为
B中溶解性由大到小的顺序为___ (填化学式),其原因是________ 。
(4)B、D两元素形成的阴离子BD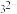 中的B的杂化类型为
中的B的杂化类型为______ ,空间结构为______ ,与BD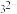 互为等电子体且含C、D两元素的微粒的化学式为
互为等电子体且含C、D两元素的微粒的化学式为______ 。
(5)A、B、C三元素各一个原子形成的分子中 键与
键与 键的个数比为
键的个数比为______ ,该分子的VSERR模型______ 。
(6)元素H的基态原子的核外电子排布为_______ ,在周期表中处于_____ 区。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为
(3)元素B与C的气态氢化物在A
 B中溶解性由大到小的顺序为
B中溶解性由大到小的顺序为(4)B、D两元素形成的阴离子BD
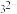 中的B的杂化类型为
中的B的杂化类型为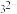 互为等电子体且含C、D两元素的微粒的化学式为
互为等电子体且含C、D两元素的微粒的化学式为(5)A、B、C三元素各一个原子形成的分子中
 键与
键与 键的个数比为
键的个数比为(6)元素H的基态原子的核外电子排布为
您最近一年使用:0次



