1 . 镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
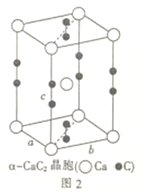
(3)一种由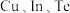 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。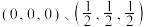 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
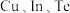 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
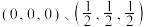 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
名校
解题方法
2 . 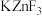 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、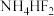 制备。回答下列问题:
制备。回答下列问题:
(1)基态Zn原子的价电子轨道表达式为___________ ;基态N原子中未成对电子数为___________ 。
(2)O的第一电离能小于N的第一电离能的原因是___________ ;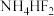 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为___________ (用元素符号表示)。
(3) 中阴离子的空间构型为
中阴离子的空间构型为___________ ;其中C原子的杂化方式为___________ 。
(4) 具有金红石型四方结构,
具有金红石型四方结构,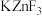 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
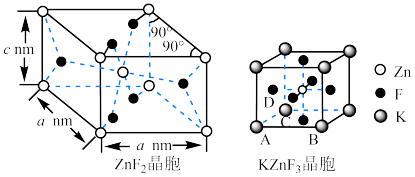
① 和
和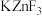 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为___________ 。
②若 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
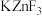 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、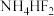 制备。回答下列问题:
制备。回答下列问题:(1)基态Zn原子的价电子轨道表达式为
(2)O的第一电离能小于N的第一电离能的原因是
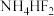 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为(3)
 中阴离子的空间构型为
中阴离子的空间构型为(4)
 具有金红石型四方结构,
具有金红石型四方结构,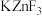 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
①
 和
和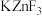 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为②若
 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-01-08更新
|
234次组卷
|
2卷引用:2024届陕西省商洛市高三上学期尖子生学情诊断考试理综试题
名校
解题方法
3 . 铬是重要的金属元素之一,其化合物有着广泛的用途。
(1)基态铬原子的核外有________ 种空间运动状态不同的电子。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是_______ (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是_______ (填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:

①阴离子中碳原子的杂化轨道类型是_______ 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是________ 。
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
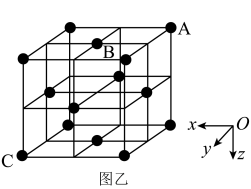
①下列为晶胞中Cr原子沿x轴方向的投影的是________ (填字母)。
a.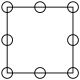 b.
b. c.
c. d.
d.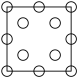
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B( ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是________ ,该原子到C原子的距离是_______ nm(用含a、b的代数式表示)。
(1)基态铬原子的核外有
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:

①阴离子中碳原子的杂化轨道类型是
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:

①下列为晶胞中Cr原子沿x轴方向的投影的是
a.
 b.
b. c.
c. d.
d.
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B(
 ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是
您最近一年使用:0次
4 . 氮的化合物在工业生产中有重要用途,请回答下列问题:
(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式);实验数据表明键角:NH3>PH3>AsH3,分析原因是_______ 。
(2)氮与碳还能形成一种离子液体的正离子 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是_______ 。
(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:
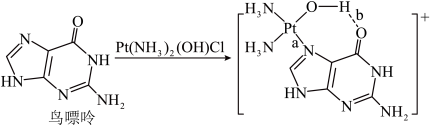
①基态Cu原子价层电子的轨道表示式为_______ ,鸟嘌呤中氮原子的杂化方式为______ 。构成鸟嘌呤的元素电负性由大到小的顺序_______ 。
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-_______ NH3(填“>”或“<”)。
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
请从分子结构角度解释顺铂在水中的溶解度大于反铂的原因是________ 。
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=_______ m3/mol(阿伏加德罗常数为NA)。(已知:单位物质的量的物质所具有的体积叫做摩尔体积)

(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N
 互为等电子体的分子:
互为等电子体的分子:(2)氮与碳还能形成一种离子液体的正离子
 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:

①基态Cu原子价层电子的轨道表示式为
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
| 顺铂 | 反铂 | |
| 结构 |  | 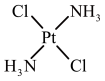 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=

您最近一年使用:0次
名校
5 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
2023-04-14更新
|
499次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
6 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
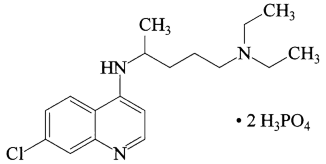
(1)基态P原子中,电子占据的最高能级符号为___ ,基态N原子核外有__ 种运动状态不同的电子。
(2)C、N、O三种元素电负性从大到小的顺序为___ ;第一电离能χ(P)__ χ(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为__ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___ 。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
①GaN、GaP、GaAs的熔点变化原因是___ 。
②砷化镓晶体中含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
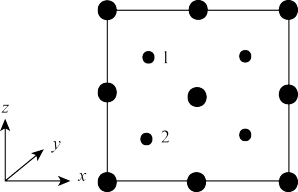
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为___ ;若磷化镓的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___ pm(用代数式表示)。

(1)基态P原子中,电子占据的最高能级符号为
(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
| GaN | GaP | GaAs | |
| 熔点/℃ | 1700 | 1480 | 1238 |
②砷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为

您最近一年使用:0次
2021-05-03更新
|
224次组卷
|
2卷引用:陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题
名校
解题方法
7 . 铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为________ 。
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
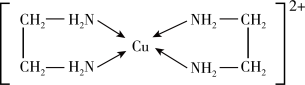
①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为________ ,C、N、H三种元素的电负性由大到小顺序是 ___ 。
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________ 。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是______ 。
(4)Cu和S形成某种晶体的晶胞如图所示。
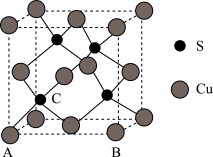
①该晶体的化学式为________ 。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率________ 。
(1)铜元素基态原子的价电子排布式为
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是
(4)Cu和S形成某种晶体的晶胞如图所示。

①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率
您最近一年使用:0次
2020-09-01更新
|
805次组卷
|
4卷引用:陕西省西安中学2020届高三第二次模拟考试化学试题
名校
解题方法
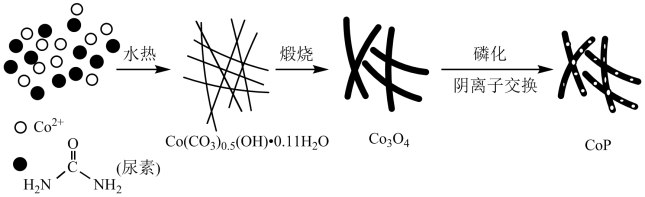
8 . 纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
(1)基态P原子的电子排布式为___ 。P在元素周期表中位于___ 区。
(2) 中碳原子的杂化类型是
中碳原子的杂化类型是___ C、N、O三种元素的第一电离能由大到小的顺序是___ (用元素符号表示),电负性由大到小的顺序为___ 。
(3)CO32-中C的价层电子对数为___ ,其空间构型为___ 。
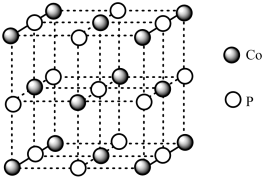
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加 德罗常数的值, 则其晶胞密度为___ g.cm-3(列出计算式即可)。

(1)基态P原子的电子排布式为
(2)
 中碳原子的杂化类型是
中碳原子的杂化类型是(3)CO32-中C的价层电子对数为
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加 德罗常数的值, 则其晶胞密度为

您最近一年使用:0次
2020-02-15更新
|
418次组卷
|
5卷引用:陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题
陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题河南天一大联考2020届高三下学期第一次模拟考试理综化学试题陕西省西安市庆华中学2020-2021学年高三上学期第二次月考化学试题湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
解题方法
9 . (1)基态Na原子中,核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子排布式为______________________ 。
(2)三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。

①第一电离能:S___________ P(填“>”或“<”,下同),电负性:S___________ P。
②三硫化四磷分子中P原子采取___________ 杂化,与PO3-互为等电子体的化合物分子的化学式为___________ 。
(3)血红素是吡咯(C4H4N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。

①1mol吡咯分子中所含的σ键总数为___________ 个。分子中的大π键可用 表示
表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______________________________________________________ 。
②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过___________ 键相结合。
(4)晶体锌和镉都是体心立方结构,如图所示。

①镉晶体的配位数为___________ 。
②已知锌晶体的密度为dg·cm-3,NA代表阿伏伽德罗常数的值。锌晶体中锌离子之间最近的核间距(D)=___________ nm。
(2)三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。

①第一电离能:S
②三硫化四磷分子中P原子采取
(3)血红素是吡咯(C4H4N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。

①1mol吡咯分子中所含的σ键总数为
 表示
表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过
(4)晶体锌和镉都是体心立方结构,如图所示。

①镉晶体的配位数为
②已知锌晶体的密度为dg·cm-3,NA代表阿伏伽德罗常数的值。锌晶体中锌离子之间最近的核间距(D)=
您最近一年使用:0次
名校
解题方法
10 . 氯磺酰氰酯(结构简式为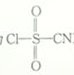 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是
(3)ClO4-的空间构型为
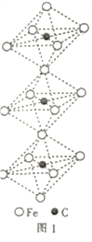
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为
您最近一年使用:0次
2018-05-25更新
|
261次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第五次模拟检测理综试题-高中化学



