名校
1 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
2023-04-14更新
|
501次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
2 . 磷是重要的生命元素之一,存在于细胞、蛋白质、骨骼和牙齿中。回答下列问题:
(1)基态P原子核外电子占据的原子轨道数为___________ 。
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为___________ ,次磷酸(H3PO2)的结构式为___________ ,次磷酸钠中各元素的电负性由大到小的顺序是___________ ,写出一种与PH3互为等电子体的离子___________ (填微粒符号)。
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是___________ 。
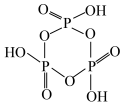
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为___________ (用含n的式子表示)。
(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为___________ ,已知该晶体的密度为ρg·cm-3,则最近的Al和P原子间的核间距为___________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。

(1)基态P原子核外电子占据的原子轨道数为
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为

(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为

您最近一年使用:0次
3 . 中国科学家在国际上首次实现了CO2到淀粉的合成,不依赖植物光合作用,原料只需CO2、H2和电,相关成果发表在《科学》上。回答下列问题:
(1)CO2的空间结构为_______ 。
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(3)淀粉在一定条件下可水解成葡萄糖(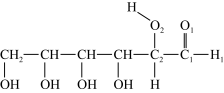 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1_______ ∠C1C2O2 (填“>”、“<”或“=”)。
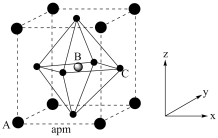
(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。
①Pb位于第六周期第IVA族,其基态原子的价电子排布图为_______ ,基态I原子核外电子占据最高能级的电子云轮廓图为_______ 。
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为_______ (用元素符号表示)。
③有机阳离子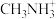 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是_______ 、_______ 。
④_______ (填“A”或“C”)代表I-,原子分数坐标A为(0,0,0),B为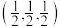 ,则C的原子分数坐标为
,则C的原子分数坐标为_______ 。NA为阿伏加德罗常数的值,则(CH3NH3)PbI3晶体的密度为_______ g∙cm-3。
(1)CO2的空间结构为
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(3)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。

①Pb位于第六周期第IVA族,其基态原子的价电子排布图为
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为
③有机阳离子
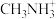 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是④
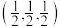 ,则C的原子分数坐标为
,则C的原子分数坐标为
您最近一年使用:0次
解题方法
4 . B和Ni均为新材料的主角。回答下列问题:
(1)基态B原子的核外电子有____ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为____ 。
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因____ 。
(3)镍可做许多有机物与氢气加成的催化剂,例如吡啶(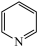 )的反应方程式为:3H2+
)的反应方程式为:3H2+
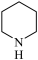 ,吡啶中大Π键可以表示为
,吡啶中大Π键可以表示为____ 。
(4)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为____ ;Ni(PPh3)2晶体中存在的化学键类型有____ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)鉴定Ni2+的特征反应如图:

在1mol鲜红色沉淀中,含有sp2杂化原子的数目为____ 个(阿伏加德罗常数的值为NA)。丁二酮肟中,各元素电负性由大到小的顺序为____ (用元素符号表示)。
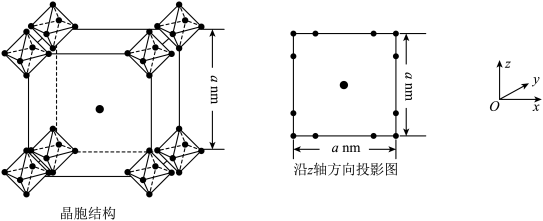
(6)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=____ g•cm-3。
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(3)镍可做许多有机物与氢气加成的催化剂,例如吡啶(
 )的反应方程式为:3H2+
)的反应方程式为:3H2+
 ,吡啶中大Π键可以表示为
,吡啶中大Π键可以表示为(4)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)鉴定Ni2+的特征反应如图:

在1mol鲜红色沉淀中,含有sp2杂化原子的数目为
(6)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=

您最近一年使用:0次
解题方法
5 . 铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态Cu原子的价电子排布式为_______ , 原子核外的电子有_______ 种空间运动状态。
(2)配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是_______ ,NH3分子的价层电子对互斥模型是_______ ,C、N、O、H的电负性由大到小的顺序为_______ 。
(3)Cu+与CN-形成的阴离子为[Cu(CN)3]2- ,该阴离子中σ键与π键数目之比为_______ 。
(4)铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为_______ 。
(5)某立方磷青铜晶体的晶胞结构如图所示。
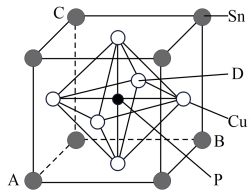
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为_______ 。
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为_______ (用含ρ、NA的代数式表示)pm。
(1)基态Cu原子的价电子排布式为
(2)配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是
(3)Cu+与CN-形成的阴离子为[Cu(CN)3]2- ,该阴离子中σ键与π键数目之比为
(4)铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为
(5)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为
您最近一年使用:0次
名校
解题方法
6 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
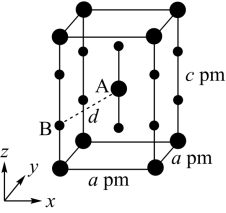
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题
陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 硼材料及含硼化合物的用途非常广泛,如B(C6F5)3可代品Cu催化重氮化合物对杂环分子的修饰、催化吲哚与苯乙炔的区域选择性加成等。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过___________ 的方法区分晶体与准晶体。
(2)B、C、F的电负性由大到小的顺序为___________ ;Be、B、C是同周期相邻元素,第一电离能: ,这是因为
,这是因为___________ 。
(3)B(C6F5)3分子中所有原子___________ (填“能”或“不能”)处于同一平面。
(4)吲哚(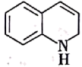 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是_________ 。
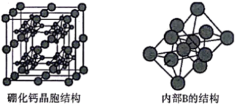
(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为___________ ,其晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态Cu原子的价电子排布式为
 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过(2)B、C、F的电负性由大到小的顺序为
 ,这是因为
,这是因为(3)B(C6F5)3分子中所有原子
(4)吲哚(
 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设
 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-11-23更新
|
194次组卷
|
3卷引用:陕西省榆林市第十中学2022届高三第五次模拟考试理综化学试题
8 . Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。
(1)基态Cr2+与Fe的未成对电子数之比为___ 。试从电子排布角度分析水溶液中Fe2+具有强还原性___ 。若是形成将其转化为(NH4)2Fe(SO4)2,在空气中相对稳定, 的空间构型为
的空间构型为___ 。
(2)由环戊二烯(C5H6, )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知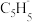 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为___ ,结构中的大π键可用符号表示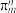 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为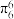 )。则
)。则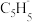 结构中含有的大π键可表示为
结构中含有的大π键可表示为___ 。
(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为___ 。几种Cr的卤化物的部分性质如表所示:
试预测CrBr3的熔点范围___ 。
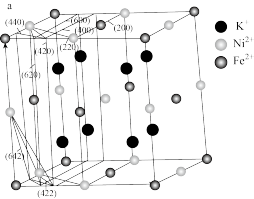
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-___ 个。该物质常用于吸附Cs+,将取代晶胞中的K+,取代后的物质的化学式为___ 。
(1)基态Cr2+与Fe的未成对电子数之比为
 的空间构型为
的空间构型为(2)由环戊二烯(C5H6,
 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知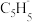 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为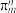 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。则
)。则 结构中含有的大π键可表示为
结构中含有的大π键可表示为(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为
| 卤化物 | CrCl3 | CrBr3 | CrI3 |
| 熔点/℃ | 1150 | 600 |
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-

您最近一年使用:0次
解题方法
9 . 金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)钛在周期表中的位置___________ , 钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO 的空间构型是
的空间构型是___________ ,第一电离能介于Al、P之间的第三周期元素为___________ (填元素符号)。
(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为___________ ,B原子的杂化方式是___________ ,其中的BH 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有___________ (填序号)
①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为___________ 、___________ 。该晶胞中B、C两个氧原子之间的核间距d=___________ pm。
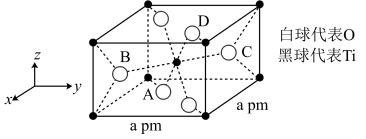
(1)钛在周期表中的位置
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO
 的空间构型是
的空间构型是(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为

您最近一年使用:0次
2021-05-14更新
|
372次组卷
|
2卷引用:陕西省西安市长安区2021届高三5月第二次模拟考试理综化学试题
解题方法
10 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
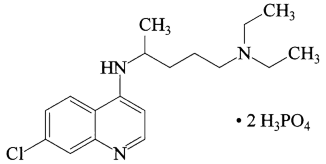
(1)基态P原子中,电子占据的最高能级符号为___ ,基态N原子核外有__ 种运动状态不同的电子。
(2)C、N、O三种元素电负性从大到小的顺序为___ ;第一电离能χ(P)__ χ(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为__ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___ 。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
①GaN、GaP、GaAs的熔点变化原因是___ 。
②砷化镓晶体中含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为___ ;若磷化镓的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___ pm(用代数式表示)。
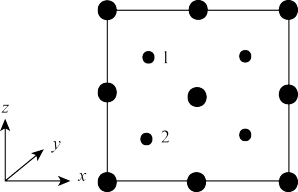

(1)基态P原子中,电子占据的最高能级符号为
(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
| GaN | GaP | GaAs | |
| 熔点/℃ | 1700 | 1480 | 1238 |
②砷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为

您最近一年使用:0次
2021-05-03更新
|
224次组卷
|
2卷引用:陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题



