陕西省安康市2023届高三下学期二模理综化学试题
陕西
高三
二模
2023-03-11
610次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础、有机化学基础
陕西省安康市2023届高三下学期二模理综化学试题
陕西
高三
二模
2023-03-11
610次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础、有机化学基础
一、单选题 添加题型下试题
单选题
|
困难(0.15)
1. 下列实验能得出相关结论的是
| 实验操作 | 实验结论 | |
| A | 向NaHA溶液中滴加紫色石蕊溶液,溶液变为蓝色 | Kw>Ka1(H2A)·Ka2(H2A) |
| B | 常温下将铝片投入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 向10mL0.1mol·L-1FeCl3溶液中加入5mL0.1mol·L-1KSCN溶液,溶液显红色,再滴加少量1mol·L-1KSCN溶液,红色加深 | Fe3+和SCN-的反应是可逆反应 |
| D | 向FeCl2溶液中滴加少量的酸性KMnO4溶液,KMnO4溶液褪色 | 氧化性: >Cl2 >Cl2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 一种重要的无机化学品广泛应用于工业和科技领域,其结构如图所示,W、X、Y、Z为原子序数依次增大的短周期主族元素。下列说法错误的是


| A.简单离子半径:X>Y>Z |
| B.简单氢化物的稳定性:Y>X |
| C.W、X、Y三种元素组成的化合物均抑制水的电离 |
| D.X和Z形成的二元化合物水解时,生成的两种产物均可与强酸反应 |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
3. 浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池。理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法错误的是
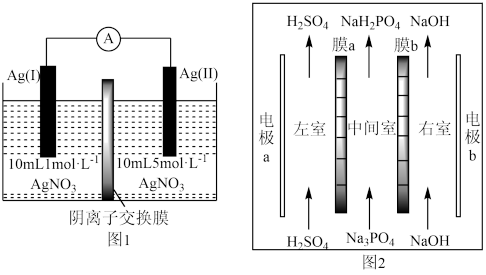

| A.电极a应与Ag(II)相连 |
| B.电渗析装置中膜b为阳离子交换膜 |
| C.电渗析过程中左、右室中H2SO4和NaOH的浓度均增大 |
| D.电池从开始到停止放电,理论上可制备2.4gNaH2PO4 |
【知识点】 原电池原理的应用 电解原理的应用 原电池、电解池综合考查解读
您最近一年使用:0次
2023-03-09更新
|
1858次组卷
|
6卷引用:陕西省安康市2023届高三下学期二模理综化学试题
单选题
|
适中(0.65)
4. 常温下,向10mL浓度均为0.1mol·L-1的NaA和HA的混合溶液中逐滴加入HA溶液或NaOH溶液,溶液中 与pH的关系如图所示。下列说法错误的是
与pH的关系如图所示。下列说法错误的是
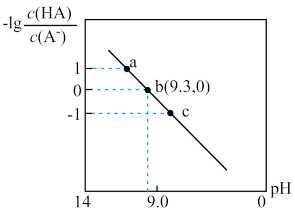
 与pH的关系如图所示。下列说法错误的是
与pH的关系如图所示。下列说法错误的是
| A.HA的电离平衡常数的数量级为10-10 |
| B.水的电离程度:a<c |
| C.原溶液是bc段之间的一个点 |
| D.c点溶液满足:c(HA)>c(Na+)>c(A-) |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
解题方法
5. 铬镀在金属上可以防锈,坚固美观。一种以铬铁矿[主要成分为Fe(CrO2)2,还含有A12O3等]为原料生成金属铬的工艺流程如下图:
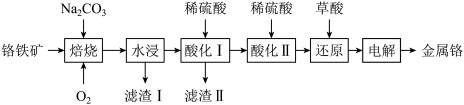
已知:①NaFeO2极易水解;
②Cr(VI)在中性或碱性溶液中以 形式存在,在酸性条件下以
形式存在,在酸性条件下以 形式存在;
形式存在;
③常温时,Al(OH)3+OH-
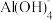 [的平衡常数:K=100.63,Al(OH)3的溶度积常数:Ksp[A1(OH)3]=10-33;
[的平衡常数:K=100.63,Al(OH)3的溶度积常数:Ksp[A1(OH)3]=10-33;
回答下列问题:。
(1)Fe(CrO2)2中铬元素的化合价为___________ 。
(2)“焙烧”时,气体和矿料逆流加入的原因是___________ , Fe(CrO2)2反应生成NaFeO2和Na2CrO4,该反应中氧化剂和还原剂的物质量之比为___________ 。
(3)“水浸”时,生成Fe(OH)3的离子方程式为___________ 。
(4)常温下,“酸化I”时,铝元素完全转化为沉淀的pH范围为___________ (通常认为溶液中离子浓度小于10-5mol·L-1沉淀完全)。
(5)“酸化Ⅱ”的目的是___________ 。
(6)“还原”时,反应的离子方程式为___________ 。
(7)“电解”时,金属铬在___________ (填“阳”或“阴”)极上产生。

已知:①NaFeO2极易水解;
②Cr(VI)在中性或碱性溶液中以
 形式存在,在酸性条件下以
形式存在,在酸性条件下以 形式存在;
形式存在;③常温时,Al(OH)3+OH-

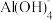 [的平衡常数:K=100.63,Al(OH)3的溶度积常数:Ksp[A1(OH)3]=10-33;
[的平衡常数:K=100.63,Al(OH)3的溶度积常数:Ksp[A1(OH)3]=10-33;回答下列问题:。
(1)Fe(CrO2)2中铬元素的化合价为
(2)“焙烧”时,气体和矿料逆流加入的原因是
(3)“水浸”时,生成Fe(OH)3的离子方程式为
(4)常温下,“酸化I”时,铝元素完全转化为沉淀的pH范围为
(5)“酸化Ⅱ”的目的是
(6)“还原”时,反应的离子方程式为
(7)“电解”时,金属铬在
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
6. 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种白色晶体,不溶于乙醇,易溶于氢氧化钠溶液,在碱性介质中稳定,在酸性条件下易发生歧化反应。某研究性学习小组利用下图所示装置制备连二亚硫酸钠并测定其纯度。回答下列问题:

(1)装置A中导管a的作用是___________ ,装置C中仪器b的名称为___________ 。
(2)装置B中单向阀的作用是___________ 。
(3)补全装置C中反应的化学方程式:___________
 HCOOH+
HCOOH+ NaOH+
NaOH+ ___________=
___________= Na2S2O4+
Na2S2O4+ CO2+
CO2+ ___________;
___________;
实验过程中需控制SO2,确保NaOH过量的原因是___________ ;充分反应后通过分液漏斗滴加一定量乙醇的目的是___________ 。
(4)装置D的作用是___________ 。
(5)充分反应后,将装置C中的混合物过滤、洗涤、干燥即得连二亚硫酸钠粗品。称量5.0g该粗品,滴加一定量的NaOH溶液使溶液显碱性后,滴加Ag-EDTA络合溶液,发生反应:2Ag++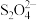 +4OH-=2Ag+2
+4OH-=2Ag+2 +2H2O,充分反应后,过滤、洗涤、干燥得到5.4g银,则该粗品中连二亚硫酸钠的质量分数为
+2H2O,充分反应后,过滤、洗涤、干燥得到5.4g银,则该粗品中连二亚硫酸钠的质量分数为___________ %。

(1)装置A中导管a的作用是
(2)装置B中单向阀的作用是
(3)补全装置C中反应的化学方程式:
 HCOOH+
HCOOH+ NaOH+
NaOH+ ___________=
___________= Na2S2O4+
Na2S2O4+ CO2+
CO2+ ___________;
___________;实验过程中需控制SO2,确保NaOH过量的原因是
(4)装置D的作用是
(5)充分反应后,将装置C中的混合物过滤、洗涤、干燥即得连二亚硫酸钠粗品。称量5.0g该粗品,滴加一定量的NaOH溶液使溶液显碱性后,滴加Ag-EDTA络合溶液,发生反应:2Ag++
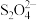 +4OH-=2Ag+2
+4OH-=2Ag+2 +2H2O,充分反应后,过滤、洗涤、干燥得到5.4g银,则该粗品中连二亚硫酸钠的质量分数为
+2H2O,充分反应后,过滤、洗涤、干燥得到5.4g银,则该粗品中连二亚硫酸钠的质量分数为
您最近一年使用:0次
7. 氢能将在实现“双碳”目标中起到重要作用,乙醇—水催化重整可获得氢气。主要发生以下反应。
反应I:C2H5OH(g)+H2O(g) 2CO(g)+4H2(g),ΔH1=+255.7kJ·mol-1
2CO(g)+4H2(g),ΔH1=+255.7kJ·mol-1
反应II:CO(g)+H2O(g) CO2(g)+H2(g),ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g),ΔH2=-41.2kJ·mol-1
回答下列问题:
(1)反应C2H5OH(g)+3H2O(g) 2CO2(g)+6H2(g)的ΔH3=
2CO2(g)+6H2(g)的ΔH3=___________ 。
(2)压强为100kPa,体积为1L的密闭容器中充入1molC2H5OH(g)和3molH2O(g)发生上述反应平衡时CO2和CO的选择性、乙醇的转化率随温度的变化曲线如图所示(已知:CO的选择性=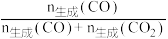 。
。
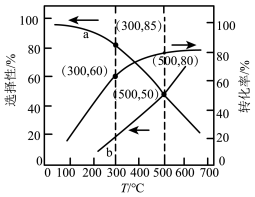
①表示CO2的选择性的是曲线___________ (填“a”或“b”);温度升高,CO2的选择性变化的原因是___________ 。
②300°C时,生成氢气的物质的量为___________ mol。
③500°C时,反应I的标准平衡常数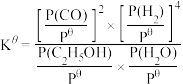 ,其中
,其中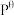 为标准压强(100kPa),P(C2H5OH)、P(H2O)、P(H2)和P(CO)为各组分的平衡分压,则
为标准压强(100kPa),P(C2H5OH)、P(H2O)、P(H2)和P(CO)为各组分的平衡分压,则 =
=___________ (已知:分压=总压×该组分物质的量分数)。
(3)为提高氢气的平衡产率,可采取的措施为___________ 。
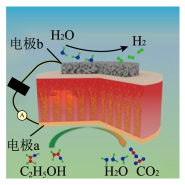
(4)生物乙醇辅助电解可以得到纯氢,其反应过程如图所示,电极b接电源的___________ 极(填“正”或“负”),阳极的电极反应式为___________ 。
反应I:C2H5OH(g)+H2O(g)
 2CO(g)+4H2(g),ΔH1=+255.7kJ·mol-1
2CO(g)+4H2(g),ΔH1=+255.7kJ·mol-1反应II:CO(g)+H2O(g)
 CO2(g)+H2(g),ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g),ΔH2=-41.2kJ·mol-1回答下列问题:
(1)反应C2H5OH(g)+3H2O(g)
 2CO2(g)+6H2(g)的ΔH3=
2CO2(g)+6H2(g)的ΔH3=(2)压强为100kPa,体积为1L的密闭容器中充入1molC2H5OH(g)和3molH2O(g)发生上述反应平衡时CO2和CO的选择性、乙醇的转化率随温度的变化曲线如图所示(已知:CO的选择性=
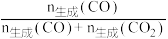 。
。
①表示CO2的选择性的是曲线
②300°C时,生成氢气的物质的量为
③500°C时,反应I的标准平衡常数
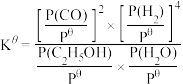 ,其中
,其中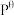 为标准压强(100kPa),P(C2H5OH)、P(H2O)、P(H2)和P(CO)为各组分的平衡分压,则
为标准压强(100kPa),P(C2H5OH)、P(H2O)、P(H2)和P(CO)为各组分的平衡分压,则 =
=(3)为提高氢气的平衡产率,可采取的措施为
(4)生物乙醇辅助电解可以得到纯氢,其反应过程如图所示,电极b接电源的

您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
解题方法
8. 磷是重要的生命元素之一,存在于细胞、蛋白质、骨骼和牙齿中。回答下列问题:
(1)基态P原子核外电子占据的原子轨道数为___________ 。
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为___________ ,次磷酸(H3PO2)的结构式为___________ ,次磷酸钠中各元素的电负性由大到小的顺序是___________ ,写出一种与PH3互为等电子体的离子___________ (填微粒符号)。
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是___________ 。
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为___________ (用含n的式子表示)。
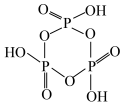
(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为___________ ,已知该晶体的密度为ρg·cm-3,则最近的Al和P原子间的核间距为___________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。

(1)基态P原子核外电子占据的原子轨道数为
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为

(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为

您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
解题方法
9. 苯妥英钠是治疗中枢疼痛综合征的药物之一,下面是一种苯妥英钠的合成路线:
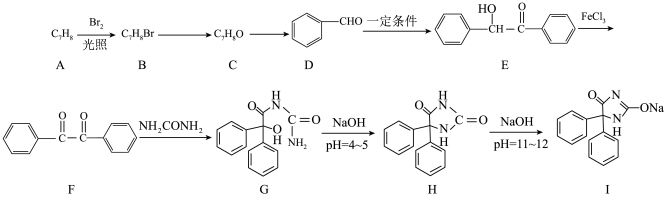
回答下列问题:
(1)A的名称为___________ 。
(2)B→C所需的反应试剂及条件为___________ 。
(3)D→E的反应类型为___________ ,E中官能团的名称为___________ 。
(4)F→G分两步完成,第一步为取代反应,第二步为加成反应,则第一步反应生成的含氮物质的结构简式为___________ 。
(5)G→H的化学方程式为___________ 。
(6)X为F的同分异构体,则满足条件的X有___________ 种,
①分子中含有 结构,且苯环上均有2个取代基;
结构,且苯环上均有2个取代基;
②1molX与足量的银氨溶液反应生成4molAg。
其中核磁共振氢谱中峰的种类最少的结构简式为___________ 。

回答下列问题:
(1)A的名称为
(2)B→C所需的反应试剂及条件为
(3)D→E的反应类型为
(4)F→G分两步完成,第一步为取代反应,第二步为加成反应,则第一步反应生成的含氮物质的结构简式为
(5)G→H的化学方程式为
(6)X为F的同分异构体,则满足条件的X有
①分子中含有
 结构,且苯环上均有2个取代基;
结构,且苯环上均有2个取代基;②1molX与足量的银氨溶液反应生成4molAg。
其中核磁共振氢谱中峰的种类最少的结构简式为
您最近一年使用:0次
试卷分析
整体难度:较难
考查范围:认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础、有机化学基础
试卷题型(共 9题)
题型
数量
单选题
4
解答题
5
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.15 | 氧化性、还原性强弱的比较 硝酸的强氧化性 可逆反应及反应限度 盐类水解规律理解及应用 | |
| 2 | 0.65 | 元素周期律、元素周期表的推断 元素非金属性强弱的比较方法 微粒半径大小的比较方法 | |
| 3 | 0.4 | 原电池原理的应用 电解原理的应用 原电池、电解池综合考查 | |
| 4 | 0.65 | 盐类水解规律理解及应用 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 二、解答题 | |||
| 5 | 0.4 | 离子方程式的书写 氧化还原反应方程式的配平 化学平衡常数的有关计算 电解池电极反应式及化学方程式的书写与判断 | 工业流程题 |
| 6 | 0.65 | 物质制备的探究 综合实验设计与评价 | 实验探究题 |
| 7 | 0.4 | 盖斯定律的应用 | 原理综合题 |
| 8 | 0.4 | 电子排布式 元素性质与电负性的关系 利用杂化轨道理论判断分子的空间构型 晶胞的有关计算 | 结构与性质 |
| 9 | 0.65 | 根据要求书写同分异构体 醛类的银镜反应 有机推断综合考查 | 有机推断题 |



