光刻技术需要利用深紫激光,我国是唯掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体KBBF(KBe2BO3F2), 实验室可用BeO、KBF4 和B2O3在700°C左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中K原子已经给出,氧原子略去),并放出BF3气体。
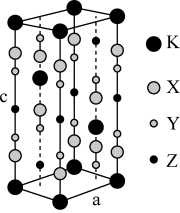
回答下列问题:
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________________ 。
(2)BF3的中心原子的杂化方式为_____________ ,与其互为等电子体的阴离子为__________ (填一种即可)。
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为__________ 。
(4)KBF4的阴离子空间构型为_________ 。
(5)三卤化硼的性质如下:
BF3、BCl3、 BBr3、BI3的沸点逐渐升高的原因是:________________________________ 。
(6)指出图中代表硼原子的字母为_________ ,该KBBF晶体的晶胞参数分别为apm和cpm, α=β=γ=90°, 则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏伽德罗常数的值,列出计算式)。

回答下列问题:
(1)基态钾原子的核外电子排布式为
(2)BF3的中心原子的杂化方式为
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4的阴离子空间构型为
(5)三卤化硼的性质如下:
BF3 | BCl3 | BBr3 | BI3 | |
熔点/°C | -127 | -107 | -46 | 49.9 |
沸点/°C | -99 | 12.5 | 91.3 | 210 |
(6)指出图中代表硼原子的字母为
更新时间:2023-05-27 16:08:35
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
请回答下列问题:
(1)E元素的电负性________ (填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________ (填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___ ,M2E2是____ (填“极性”或“非极性”)分子。
(4)L的价电子排布式为________ ,该元素位于周期表中的________ 族。
(5)R的化学式为____________ (用元素符号表示),属于________ 晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________ cm。(阿伏伽德常数用NA表示)

请回答下列问题:
(1)E元素的电负性
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是
(4)L的价电子排布式为
(5)R的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为_________ ;砷与溴的第一电离能较大的是_________ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是_________ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为_________ ,与其互为等电子体的一种分子为__________ 。

(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为_________ ,As原子采取___________ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与_______ 个Ga相连,As与Ga之间存在的化学键有________ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
(1)基态砷原子的电子排布式为
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为

(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为_________ 。元素锗与砷中,第一电离能较大的是_________ (填元素符号,下同),基态原子核外未成对电子数较少的是_______________ 。
(2)H2SeO3分子中Se原子的杂化形式为____________ ,H2SeO4的酸性比H2SeO3强,原因是_________ 。
(3)气态SeO3分子的立体构型为____________ ,与SeO3互为等电子体的一种离子为_______ (填离子符号)。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____________ ,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏伽德罗常数的数值,则晶胞参数ɑ为____________ nm。
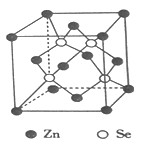
(1)锌基态原子核外电子排布式为
(2)H2SeO3分子中Se原子的杂化形式为
(3)气态SeO3分子的立体构型为
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】臭氧( )在
)在 催化下可以将烟气中的
催化下可以将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可以在其他条件下被还原为
也可以在其他条件下被还原为 。回答下列问题:
。回答下列问题:
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为_______ ,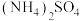 的晶体类型为
的晶体类型为_______ 晶体。
(2) 基态核外电子排布式为
基态核外电子排布式为_______ 。
(3)N、H、O三种元素的电负性由小到大的顺序为_______ 。
(4) 的沸点高于
的沸点高于 ,这是因为
,这是因为_______ 。
(5) 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
 )在
)在 催化下可以将烟气中的
催化下可以将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可以在其他条件下被还原为
也可以在其他条件下被还原为 。回答下列问题:
。回答下列问题:(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为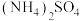 的晶体类型为
的晶体类型为(2)
 基态核外电子排布式为
基态核外电子排布式为(3)N、H、O三种元素的电负性由小到大的顺序为
(4)
 的沸点高于
的沸点高于 ,这是因为
,这是因为(5)
 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下表是元素周期表的一部分,其中的字母编号代表对应的元素。试回答问题:
(1)元素⑦的原子结构示意图为_______ ,元素⑨价电子的轨道表示式为 _______ 。
(2)元素④基态原子核外共有_______ 种不同运动状态的电子,未成对电子数共有_______ 个。
(3)元素③的最简单氢化物分子的空间构型为_______ ,该氢化物含有_______ (填“极性”或“非极性”)键。
(4)③④⑤三种元素的原子电负性由小到大的顺序是_______ (用元素符号表示)。
(5)⑤⑥⑧三种元素的原子半径由大到小的顺序是_______ (用元素符号表示)。
(6)由元素⑩形成的1mol晶体中,含有的共价键为_______ mol。
| ① | ② | ③ | ④ | ⑤ | |||||||||||||
| ⑥ | ⑦ | ⑩ | ⑧ | ||||||||||||||
| ⑨ | |||||||||||||||||
(2)元素④基态原子核外共有
(3)元素③的最简单氢化物分子的空间构型为
(4)③④⑤三种元素的原子电负性由小到大的顺序是
(5)⑤⑥⑧三种元素的原子半径由大到小的顺序是
(6)由元素⑩形成的1mol晶体中,含有的共价键为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】硅和卤素单质反应可以得到SiX4。
SX4的熔沸点
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),沸点依次升高的原因是___________ ,气态SiX4分子的空间构型是___________ ;
②SiCl4与N﹣甲基咪唑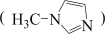 反应可以得到M2+,其结构如图所示:
反应可以得到M2+,其结构如图所示:
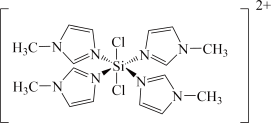
N-甲基咪唑分子中碳原子的杂化轨道类型为___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键;
SX4的熔沸点
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N﹣甲基咪唑
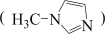 反应可以得到M2+,其结构如图所示:
反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)C、N、O元素的第一电离能大小为:_________ 。
(2)Cu的价电子排布式 为______ ,基态Fe原子有_____ 个未成对电子,Fe3+的价电子排布图 为________ 。
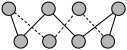
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________ 。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______ 。S8易溶于二硫化碳的原因是_________ 。
(4)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
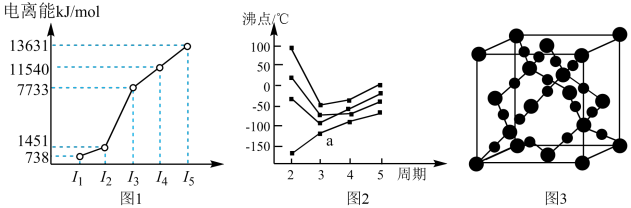
(a)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____ 种不同运动状态的电子。
(b)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于______ 晶体。
(c)如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___ 。判断依据____ 。
(2)Cu的
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为

(4)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:

(a)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有
(b)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于
(c)如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F原子基态的价电子排布式为_______________ 。
(2)在A、B、C三种元素中,电负性由大到小的顺序是______ >______ >_____ (用元素符号回答)。
(3)元素C的简单气态氢化物的沸点远高于元素E的简单气态氢化物的沸点,其主要原因是________________________ 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的空间构型为_____________ 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_______________ 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为________________________ 。

(1)F原子基态的价电子排布式为
(2)在A、B、C三种元素中,电负性由大到小的顺序是
(3)元素C的简单气态氢化物的沸点远高于元素E的简单气态氢化物的沸点,其主要原因是
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的空间构型为
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
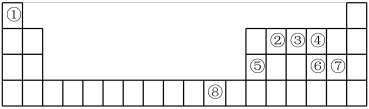
(1)元素⑧的基态原子价电子排布式为_______ 。
(2)元素②③④的第一电离能由大到小的顺序是_______ (填元素符号)。
(3)元素③④⑤形成的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(4)元素④⑥的简单气态氢化物更稳定的是_______ ,键角更大的是_______ (填化学式)。
(5)元素③的最高价含氧酸根的中心原子杂化方式为_______ ,其空间结构为_______ 。
(6)由元素⑦⑧组成的化合物溶于水后溶液呈蓝色,滴加稀盐酸变成黄绿色,从平衡移动角度解释上述颜色变化过程:_______ (用离子方程式表示)。

(1)元素⑧的基态原子价电子排布式为
(2)元素②③④的第一电离能由大到小的顺序是
(3)元素③④⑤形成的简单离子半径由大到小的顺序为
(4)元素④⑥的简单气态氢化物更稳定的是
(5)元素③的最高价含氧酸根的中心原子杂化方式为
(6)由元素⑦⑧组成的化合物溶于水后溶液呈蓝色,滴加稀盐酸变成黄绿色,从平衡移动角度解释上述颜色变化过程:
您最近一年使用:0次
【推荐1】A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B_______ ,G_______ 。
(2)写出F的价电子排布图:_______ 。
(3)写出化合物BC的结构式:__________________ 。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是________________ 。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是______________________ 。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有_______ 个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为____ pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)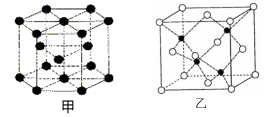
(1)写出元素名称:B
(2)写出F的价电子排布图:
(3)写出化合物BC的结构式:
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是
(6)E的一种晶体结构如图甲,则其一个晶胞中含有
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】芯片作为科技产业,以及信息化、数字化的基础,自诞生以来,就一直倍受关注,也一直蓬勃发展。芯片制造会经过六个最为关键的步骤;沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。
①镓为第四周期元素,基态Ga原子的核外电子排布为:___________ ;
②GaN、GaP、GaAs的结构类似于金刚石,熔点如表所示:试分析三者熔点变化的原因___________ 。
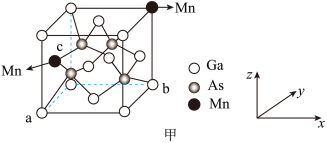
③将Mn掺杂到GaAs的晶体中替换部分Ga得到稀磁性半导体材料,晶体结构如甲图。___________ 。
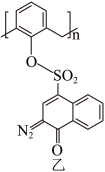
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S的杂化方式为___________ 。 及清洗剂
及清洗剂 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为___________ ,HF分子的极性___________ (填“大于”“等于”或“小于”)HCl,1mol氟硼酸铵 中含有
中含有___________ mol配位键。
(4)LiF晶体结构属于氯化钠型。
①LiF的熔点和沸点比NaCl的高,请解释原因___________ 。
②LiF晶体的密度约为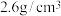 ,LiF晶胞的体积约为
,LiF晶胞的体积约为___________ cm3(计算结果保留一位有效数字)。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。
①镓为第四周期元素,基态Ga原子的核外电子排布为:
②GaN、GaP、GaAs的结构类似于金刚石,熔点如表所示:试分析三者熔点变化的原因
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S的杂化方式为
 及清洗剂
及清洗剂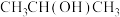 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为 中含有
中含有(4)LiF晶体结构属于氯化钠型。
①LiF的熔点和沸点比NaCl的高,请解释原因
②LiF晶体的密度约为
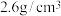 ,LiF晶胞的体积约为
,LiF晶胞的体积约为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:
(1)基态铜原子价电子排布式为___________ 。
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
① 中N原子的杂化类型是
中N原子的杂化类型是___________ ;NH3分子的立体构型是___________ 。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有___________ 个未成对电子。1 mol该阳离子含有的σ键数目为___________
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是___________ ,NH3的沸点比NF3___________ ( 选填“高”或“低”),原因是___________ 。
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:
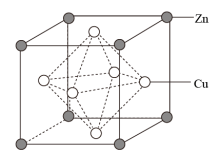
已知:晶胞参数为a nm。
①合金中粒子间作用力类型是___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③黄铜合金晶体密度为___________ g·cm-3。(设NA为阿伏加德罗常数的值)
(1)基态铜原子价电子排布式为
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①
 中N原子的杂化类型是
中N原子的杂化类型是②[Cu(NH3)4]2+中提供孤对电子的基态原子有
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为a nm。
①合金中粒子间作用力类型是
②与Cu原子等距离且最近的Cu原子有
③黄铜合金晶体密度为
您最近一年使用:0次



