解题方法
1 . .氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态 Ti 原子的价层电子排布为____________ ,核外共有________________ 种能量不同的电子;
②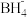 的空间构型是
的空间构型是_______________ 。
(2)液氨是富氢物质,是氢能的理想载体,利用 N2+3H2 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是 _______________ 。
A.NH3分子中 N 原子采用 sp3杂化 B.NH3和 是等电子体
是等电子体
C.CN-的电子式为[··C︙︙N··]- D.相同压强时,NH3 沸点比 PH3高
(3)2008 年,Yoon 等人发现 Ca 与 C60生成的 Ca32C60能大量吸附 H2分子。
①C60晶体易溶于苯、CS2,说明C60是_______________ (填“极性”或“非极性”)分子;
②C60分子结构如图所示,则 12gC60分子中含有σ键数目为_______________ (用 NA表示)。
①MgH2遇水就能释放 H2,该反应的化学方程式为________________ ;
②已知该晶体的密度为 a g/cm-3,则该晶胞的体积为________________ cm3(用 a、NA表示)。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态 Ti 原子的价层电子排布为
②
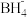 的空间构型是
的空间构型是(2)液氨是富氢物质,是氢能的理想载体,利用 N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是 A.NH3分子中 N 原子采用 sp3杂化 B.NH3和
 是等电子体
是等电子体C.CN-的电子式为[··C︙︙N··]- D.相同压强时,NH3 沸点比 PH3高
(3)2008 年,Yoon 等人发现 Ca 与 C60生成的 Ca32C60能大量吸附 H2分子。
①C60晶体易溶于苯、CS2,说明C60是
②C60分子结构如图所示,则 12gC60分子中含有σ键数目为

①MgH2遇水就能释放 H2,该反应的化学方程式为
②已知该晶体的密度为 a g/cm-3,则该晶胞的体积为
您最近一年使用:0次
2020-09-26更新
|
151次组卷
|
3卷引用:湖北省宜昌市第二中学2021届高三起点考试化学试题
解题方法
2 . 铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___ 摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____ 晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____ 。
(3)铁氰化钾K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____ 。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____ 。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____ 。
④铁氰化钾中,不存在___ (填字母标号)。
A.离子键B.σ键C.π键D.氢键E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 ),则
),则 中的大Π键应表示为
中的大Π键应表示为____ ,其中碳原子的杂化方式为____ 。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__ mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___ ;六棱柱底边长为acm,高为c cm,阿伏加 德罗常数的值为NA,则该磁性氮化铁的晶体密度为____ g/cm3(列出计算式)。

(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于
(3)铁氰化钾K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为
④铁氰化钾中,不存在
A.离子键B.σ键C.π键D.氢键E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号
 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 ),则
),则 中的大Π键应表示为
中的大Π键应表示为(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为

您最近一年使用:0次
2019-09-11更新
|
295次组卷
|
2卷引用:湖北省武汉市部分学校2020届新高三起点质量监测化学试题
解题方法
3 . 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________ ,C、N、O三种元素的第一电离能由大到小的顺序为_________ 。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2−, 1 mol CN−中含有的π键的数目为_________ 。与CN−互为等电子体的分子有_______ (写出一种即可)。
(3)在络离子[Cu(NH3)4] 2+中 NH3 的 VSEPR 模型为____________ ,其中N原子的杂化轨道类型为_________ 。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________________ 。
(5)晶体是由无数晶胞___________ 而成。铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为______ ,若该晶胞的晶胞参数为d nm,则该合金的密度为______ g/cm3 (不必化简,用NA表示阿伏加德罗常数)。

(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2−, 1 mol CN−中含有的π键的数目为
(3)在络离子[Cu(NH3)4] 2+中 NH3 的 VSEPR 模型为
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是
(5)晶体是由无数晶胞

您最近一年使用:0次



