13-14高二·全国·课后作业
名校
1 . 如表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是


| A.W、R元素单质分子内都存在非极性键 |
| B.X、Z元素都能形成双原子分子 |
| C.键长:W—H键<Y—H键,键的极性:Y—H键>W—H键 |
| D.键长:X—H键<W—H键,键能:X—H键<W—H键 |
您最近一年使用:0次
2021-04-30更新
|
612次组卷
|
12卷引用:安徽省霍邱县第二中学2019-2020学年高二下学期开学考试化学试题
安徽省霍邱县第二中学2019-2020学年高二下学期开学考试化学试题(已下线)2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(已下线)同步君 选修3 第二章 第一节 键参数和等电子体高中化学人教版 选修三 第2章 分子结构与性质 键参数——键能、键长与键角河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.1 第2课时江苏省苏州市相城区陆慕高级中学2019-2020学年高二下学期在线学习质量检测化学试题新疆昌吉市教育共同体2019-2020学年高二下学期期中考试化学试题安徽省白泽湖中学2020-2021学年高二下学期期中考试化学试题(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)第一节 共价键 第2课时 键参数——键能、键长和键角山东省东营市利津县高级中学2023-2024学年高二12月月考化学试题
名校
解题方法
2 . 下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 碘单质在CCl4中溶解度比在水中大 | CCl4和I2都是非极性分子,而H2O是极性分子 |
| B | CO2为直线形分子 | CO2分子中C═O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是共价晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-04-07更新
|
149次组卷
|
10卷引用:安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题
安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题安徽省亳州市涡阳县第九中学2019-2020学年高二7月月考化学试题甘肃省兰州市第一中学2017-2018学年高二下学期期中考试化学试题【全国百强校】新疆兵团第二师华山中学2017-2018学年高二下学期期末考试化学试题山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题辽宁省丹东市第四中学2019-2020学年高二 4 月线上月考化学试题河南省漯河市临颍县南街高中2020-2021学年高二上学期期中考试化学试题四川省南充高级中学2020-2021学年高二下学期入学考试化学试题
名校
解题方法
3 . 下列叙述中正确的有
① 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③运用价层电子对互斥理论,CO32-离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
①
 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③运用价层电子对互斥理论,CO32-离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
| A.1个 | B.2个 | C.3个 | D.4个 |
您最近一年使用:0次
2020-03-09更新
|
221次组卷
|
3卷引用:安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题
名校
解题方法
4 . 锰单质及其化合物应用十分广泛。回答下列问题:
(1)基态锰原子的核外电子排布式为___ ,Mn成为阳离子时首先失去___ 轨道电子。
(2)MnO和MnS的熔点分别为1650℃和1610℃,前者熔点较高的原因是__ 。
(3)锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。

①THF中与Mn2+形成配位键的原子为__ (填元素符号)。
②BH4-的空间构型为__ ,写出两种与BH4-互为等电子体的分子或离子__ 。
(4)某种含锰特殊材料的晶胞结构如图所示,该晶体的化学式为__ ;其中原子坐标参数A为(0,0,0),B为(0, ,
, ),则晶胞中氮原子的坐标参数为
),则晶胞中氮原子的坐标参数为__ 。

(5)金属锰有多种晶型,其中δ-Mn的结构为体心立方堆积,晶胞参数为apm,δ-Mn中锰的原子半径为__ pm。已知阿伏加 德罗常数的值为NA,δ-Mn的理论密度ρ=__ g•cm-3(列出计算式)。
(1)基态锰原子的核外电子排布式为
(2)MnO和MnS的熔点分别为1650℃和1610℃,前者熔点较高的原因是
(3)锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。

①THF中与Mn2+形成配位键的原子为
②BH4-的空间构型为
(4)某种含锰特殊材料的晶胞结构如图所示,该晶体的化学式为
 ,
, ),则晶胞中氮原子的坐标参数为
),则晶胞中氮原子的坐标参数为
(5)金属锰有多种晶型,其中δ-Mn的结构为体心立方堆积,晶胞参数为apm,δ-Mn中锰的原子半径为
您最近一年使用:0次
2020-02-26更新
|
134次组卷
|
3卷引用:安徽省泗县第一中学2022届高三上学期开学考试化学试题
安徽省泗县第一中学2022届高三上学期开学考试化学试题河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
名校
5 . 下列说法不正确的是
| A.沸点:H2O>HF | B.热稳定性:HF>H2O |
| C.NCl3、SiCl4分子中每个原子最外层均满足8电子结构 | D.仅由N、H、O三种元素形成的化合物中不可能含离子键 |
您最近一年使用:0次
2019-09-17更新
|
642次组卷
|
18卷引用:安徽省颍上县实验中学2019-2020学年高二上学期开学考试化学试题
安徽省颍上县实验中学2019-2020学年高二上学期开学考试化学试题浙江省金华十校2017~2018学年第一学期期末调研考试高一化学试题河北省邢台市第二中学2017-2018学年高一下学期第一次月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一4月月考化学试题云南省丘北二中2018-2019学年高一下学期6月份月考化学试题陕西省黄陵中学高新部2018-2019学年高一下学期期末考试化学试题云南省文山州马关县二中2019-2020学年高二上学期9月份考试化学试题福建省漳州市第一中学2019-2020学年高一3月在线测试(实验班)化学试题湖北省武汉市第三十九中学2019-2020学年高一下学期线上期中考试化学试题沪科版化学拓展性课程1《原子结构与元素周期律》测试题四川省眉山市仁寿第二中学、华兴中学2019-2020学年高一下学期5月联考(期中)化学试题广东省江门市第二中学2019-2020学年高一下学期第二次考试(期中)化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题江苏省宜兴一中2020-2021学年高一上学期第二次阶段性考试化学试题贵州省毕节市金沙县第一中学2020-2021学年高一下学期第一次月考化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题四川省华蓥中学2020-2021学年高一下学期5月月考化学考试题云南省马关县第一中学2021-2022学年高二下学期2月份考试化学试题
名校
6 . 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
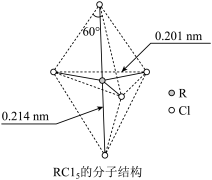

| A.每个原子都达到8电子稳定结构 |
| B.分子中5个R—Cl键键能不相同 |
| C.键角(Cl—R—Cl)有90°、120°、180°几种 |
| D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子 |
您最近一年使用:0次
2019-05-28更新
|
226次组卷
|
11卷引用:安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题
安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期5月月考化学试题江苏省溧水高级中学2018-2019高二上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期中考试化学试题山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题福建省福州市八县一中2019-2020学年高二年下学期适应性考试化学试题山西省朔州市怀仁县怀仁一中云东校区2019-2020学年高二下学期期中考试化学试题河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题福建省厦门英才学校中学部22021-2022学年高二下学期4月月考化学试题福建省厦门市湖滨中学2022-2023学年高二下学期期中考试化学试题
真题
名校
7 . Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是_________________ 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的_________ 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________ 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为____________ (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为___________ 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于___________ 。
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
您最近一年使用:0次
2019-01-30更新
|
1110次组卷
|
12卷引用:2020年安徽省全省教学质量检测统一考试(练习检测一)
2020年安徽省全省教学质量检测统一考试(练习检测一)2009年普通高等学校招生统一考试理综试题化学部分(福建卷)(已下线)2011届山西省山大附中高三高考模拟题试题(理综)化学部分(已下线)2012届云南省红河州高三5月统一检测理科综合化学试卷(已下线)2014-2015学年山东桓台第二中学高二上学期(10月)检测化学试卷(已下线)2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷2014-2015福建省漳浦县三校高二下学期期中化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷福建省莆田市第一中学2016-2017学年高二下学期期中考试化学试题四川省南充市白塔中学2019-2020学年高二12月月考化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期末考试化学试题(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
名校
解题方法
8 . 下列说法错误的是
| A.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
B.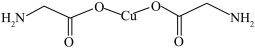 σ键和π键比例为7:1 σ键和π键比例为7:1 |
C. 与 与 互为等电子体,1 mol 互为等电子体,1 mol  中含有的π键数目为2NA 中含有的π键数目为2NA |
| D.已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA |
您最近一年使用:0次
2018-09-07更新
|
258次组卷
|
8卷引用:【全国百强校】安徽省合肥市第六中学2018-2019学年高二下学期开学考试化学试题
9 . 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4HCO3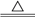 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| B.NH3+HCl===NH4Cl |
| C.2KOH+Cl2===KCl+KClO+H2O |
| D.2K2O2+2CO2===2K2CO3+O2 |
您最近一年使用:0次
2018-04-14更新
|
335次组卷
|
4卷引用:安徽省阜阳市2019-2020学年高一下学期开学考化学试题
安徽省阜阳市2019-2020学年高一下学期开学考化学试题吉林省长春市十一高中等九校教育联盟2017-2018学年高一下学期期初考试化学试题河南省新乡市辉县市第二高级中学2019-2020学年高一下学期第一次月考试化学试题(A部)(已下线)第五章 物质结构与性质元素周期律 第29练 化学键 分子的空间结构
名校
解题方法
10 . 下列描述中正确的是
| A.CS2 为空间构型为 V 形的极性分子 |
| B.双原子或多原子形成的气体单质中,一定有σ键,可能有π键 |
| C.氢原子电子云的一个小黑点表示一个电子 |
| D.HCN、SiF4 和 SO32- 的中心原子均为 sp3 杂化 |
您最近一年使用:0次
2018-01-18更新
|
407次组卷
|
8卷引用:【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题
【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2017-2018学年高二上学期期末考试化学试题【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题【全国百强校】福建省厦门第一中学2018-2019学年高二上学期期中考试化学试题(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)



