1 . 填空
(1)基态铜原子价层电子排布图为______ ﹔已知Cu第一电离能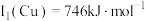 ,Fe第一电离能
,Fe第一电离能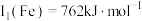 ,则
,则
______  (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是______ ;
(2) 和
和 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为______ ,试判断 和
和 的键角大小关系:
的键角大小关系:
______  ,说明原因:
,说明原因:______
(3)比较 和
和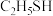 的酸性:
的酸性:
______ 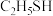 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)基态铜原子价层电子排布图为
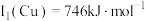 ,Fe第一电离能
,Fe第一电离能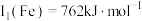 ,则
,则
 (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是(2)
 和
和 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为 和
和 的键角大小关系:
的键角大小关系:
 ,说明原因:
,说明原因:(3)比较
 和
和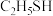 的酸性:
的酸性:
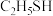 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2024-04-03更新
|
344次组卷
|
2卷引用:浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题
23-24高二上·广东深圳·期末
名校
2 . 根据所学知识,回答下列问题:
(1)Cu的简化电子排布式为___________ 。Fe2+的价电子轨道表示式为___________ 。
(2)乙炔分子中σ键与π键个数之比为___________ 。
(3)吡啶( )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据___________ 轨道。
(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为___________ 。
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为___________ 。
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为___________ 。
(1)Cu的简化电子排布式为
(2)乙炔分子中σ键与π键个数之比为
(3)吡啶(
 )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为
您最近一年使用:0次
2024-02-24更新
|
579次组卷
|
4卷引用:广东省深圳中学2023-2024学年高二上学期期末考试化学试题
(已下线)广东省深圳中学2023-2024学年高二上学期期末考试化学试题(已下线)广东省深圳市深圳中学2023-2024学年高二上学期期末考试化学试题名校期末好题汇编-分子结构与性质(非选择题)广东省潮州市饶平县第二中学2023-2024学年高二下学期第一次月考化学试题
3 . 认真做作业一定会有收获,试试看,成功就在眼前。
(1)已知 晶体原子间均以单键结合成空间网状结构,下列关于
晶体原子间均以单键结合成空间网状结构,下列关于 晶体的说法正确的是___________。
晶体的说法正确的是___________。
(2)下列有关共价化合物的说法一定正确的是___________。
①具有较低的熔沸点②不是电解质③固态时是分子晶体④都是由分子构成的⑤液态时不导电
(3)分类方法在化学学科的发展中起到了重要的作用,下列说法合理的是___________。
(4)实验室制取氯化氢的化学方程式为___________ ;在标准状况下,甲乙两同学用两瓶纯度不同的氯化氢气体,进行喷泉实验,实验后,甲同学溶液充满整个烧瓶,乙同学溶液充满烧瓶的三分之二,则甲乙同学得到盐酸的物质的量浓度比为___________ (假设溶质不扩散,装置不漏气)
(5)向 溶液中逐滴加入稀硫酸,请完成下列问题:
溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式___________ 。
②下列三种情况下,离子方程式与①不相同的是___________ (填序号)。
A.向 溶液中,逐滴加入
溶液中,逐滴加入 溶液至溶液显中性
溶液至溶液显中性
B.向 溶液中,逐滴加入
溶液中,逐滴加入 溶液至
溶液至 恰好完全沉淀
恰好完全沉淀
C.向 溶液中,逐滴加入
溶液中,逐滴加入 溶液至过量
溶液至过量
(1)已知
 晶体原子间均以单键结合成空间网状结构,下列关于
晶体原子间均以单键结合成空间网状结构,下列关于 晶体的说法正确的是___________。
晶体的说法正确的是___________。A. 晶体是分子晶体 晶体是分子晶体 |
B. 晶体中,C—N键的键长比金刚石中的C—C键的键长长 晶体中,C—N键的键长比金刚石中的C—C键的键长长 |
C. 晶体熔点比金刚石更高 晶体熔点比金刚石更高 |
D. 晶体中每个C原子连接3个N原子,而每个N原子连接4个C原子 晶体中每个C原子连接3个N原子,而每个N原子连接4个C原子 |
①具有较低的熔沸点②不是电解质③固态时是分子晶体④都是由分子构成的⑤液态时不导电
| A.①③④ | B.②⑤ | C.①②③④⑤ | D.⑤ |
| A.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸、三元酸等 |
| B.根据其水溶液是否能导电,将物质分为电解质和非电解质 |
| C.根据溶于水的酸碱性将氧化物分为酸性氧化物和碱性氧化物 |
| D.金属置换金属,非金属置换非金属,金属置换非金属,非金属置换金属四类置换反应均存在 |
(5)向
 溶液中逐滴加入稀硫酸,请完成下列问题:
溶液中逐滴加入稀硫酸,请完成下列问题:①写出反应的离子方程式
②下列三种情况下,离子方程式与①不相同的是
A.向
 溶液中,逐滴加入
溶液中,逐滴加入 溶液至溶液显中性
溶液至溶液显中性B.向
 溶液中,逐滴加入
溶液中,逐滴加入 溶液至
溶液至 恰好完全沉淀
恰好完全沉淀C.向
 溶液中,逐滴加入
溶液中,逐滴加入 溶液至过量
溶液至过量
您最近一年使用:0次
名校
解题方法
4 . 氮、氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有___________ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为___________ 。
(2)氟气可以用于制取惰性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。
① 分子的空间结构为
分子的空间结构为___________ 。
②S、P、Si的第一电离能由大到小的顺序为___________ 。
(3)Na与N形成的 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为___________ 。
(4)键角比较:
___________  (填“>”或“<”),其原因为
(填“>”或“<”),其原因为___________ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取惰性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。①
 分子的空间结构为
分子的空间结构为②S、P、Si的第一电离能由大到小的顺序为
(3)Na与N形成的
 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为(4)键角比较:

 (填“>”或“<”),其原因为
(填“>”或“<”),其原因为
您最近一年使用:0次
名校
5 . 卤素单质及其化合物在生产、生活、化工、医药、材料等领域中有着非常广泛的应用。回答下列问题:
(1)基态Br原子的价层电子轨道表示式为__________ 。
(2)下列现象中,不能用“相似相溶”原理解释的是__________(填序号)。
(3)卤族元素除F元素外,Cl、Br、I均可形成多种含氧酸根,① ;②
;②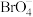 ;③
;③ 中键角最大的是
中键角最大的是__________ (填序号)。
(4)光气( )在有机合成中常作氯化剂,分子中所有原子均满足8电子稳定结构,
)在有机合成中常作氯化剂,分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为__________ 。
(5)请在下图含溴有机物的结构简式中,用星号(*)标出含有的手性碳原子__________ 。 的数值来衡量。室温下,
的数值来衡量。室温下, ;
; ,依据数据分析,酸性:
,依据数据分析,酸性:
__________  (填“>”“<”或“=”),请从键的极性角度解释原因
(填“>”“<”或“=”),请从键的极性角度解释原因__________ 。
(1)基态Br原子的价层电子轨道表示式为
(2)下列现象中,不能用“相似相溶”原理解释的是__________(填序号)。
A.HCl易溶于 | B. 易溶于NaOH溶液 易溶于NaOH溶液 |
C. 易溶于 易溶于 | D. 易溶于 易溶于 |
 ;②
;②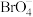 ;③
;③ 中键角最大的是
中键角最大的是(4)光气(
 )在有机合成中常作氯化剂,分子中所有原子均满足8电子稳定结构,
)在有机合成中常作氯化剂,分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(5)请在下图含溴有机物的结构简式中,用星号(*)标出含有的手性碳原子
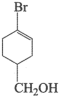
 的数值来衡量。室温下,
的数值来衡量。室温下, ;
; ,依据数据分析,酸性:
,依据数据分析,酸性:
 (填“>”“<”或“=”),请从键的极性角度解释原因
(填“>”“<”或“=”),请从键的极性角度解释原因
您最近一年使用:0次
2024-01-13更新
|
482次组卷
|
3卷引用:辽宁省锦州市2023-2024学年高二上学期1月期末化学试题
6 . 石灰氮( )是一种氮素肥效长的固态肥料,同时也是一种低毒、无残留的农药。工业上高温制备原理之一为
)是一种氮素肥效长的固态肥料,同时也是一种低毒、无残留的农药。工业上高温制备原理之一为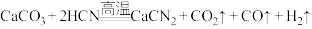 。回答下列问题:
。回答下列问题:
(1)已知 和
和 同族,
同族, 的原子序数为50,基态
的原子序数为50,基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)基态氧原子的价层电子排布式不能表示为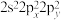 ,因为这违背了
,因为这违背了___________ (填标号)。
A.泡利原理 B.能量最低原理 C.洪特规则
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是___________(填标号)。
(4) 的空间结构为
的空间结构为___________ 。 具有较强的配位能力,能与
具有较强的配位能力,能与 形成一种无限长链离子,其片段为
形成一种无限长链离子,其片段为 ,则
,则 与
与 形成的离子的化学式为
形成的离子的化学式为___________ 。
(5)反应前 需用
需用 干燥。
干燥。 的分子结构如图所示。
的分子结构如图所示。 、
、 、
、 三种氧化物的熔点由高到低的顺序为
三种氧化物的熔点由高到低的顺序为___________ 。
②上述结构中连接2个 原子的
原子的 原子称为桥氧,连接1个
原子称为桥氧,连接1个 原子的
原子的 原子称为端基氧,则与
原子称为端基氧,则与 原子形成的化学键的键长更短的
原子形成的化学键的键长更短的 原子是
原子是___________ (填“桥氧”或“端基氧”),原因是___________ 。
(6)石灰氮晶体晶胞参数如图所示,其中棱长和高分别为 、
、 、
、 ,该晶体的密度为
,该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是一种氮素肥效长的固态肥料,同时也是一种低毒、无残留的农药。工业上高温制备原理之一为
)是一种氮素肥效长的固态肥料,同时也是一种低毒、无残留的农药。工业上高温制备原理之一为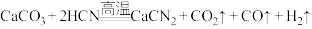 。回答下列问题:
。回答下列问题:(1)已知
 和
和 同族,
同族, 的原子序数为50,基态
的原子序数为50,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)基态氧原子的价层电子排布式不能表示为
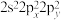 ,因为这违背了
,因为这违背了A.泡利原理 B.能量最低原理 C.洪特规则
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.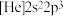 | B.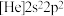 | C.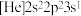 | D.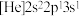 |
(4)
 的空间结构为
的空间结构为 具有较强的配位能力,能与
具有较强的配位能力,能与 形成一种无限长链离子,其片段为
形成一种无限长链离子,其片段为 ,则
,则 与
与 形成的离子的化学式为
形成的离子的化学式为(5)反应前
 需用
需用 干燥。
干燥。 的分子结构如图所示。
的分子结构如图所示。
 、
、 、
、 三种氧化物的熔点由高到低的顺序为
三种氧化物的熔点由高到低的顺序为②上述结构中连接2个
 原子的
原子的 原子称为桥氧,连接1个
原子称为桥氧,连接1个 原子的
原子的 原子称为端基氧,则与
原子称为端基氧,则与 原子形成的化学键的键长更短的
原子形成的化学键的键长更短的 原子是
原子是(6)石灰氮晶体晶胞参数如图所示,其中棱长和高分别为
 、
、 、
、 ,该晶体的密度为
,该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
7 . 氯吡苯脲能在动物体内代谢,其产物较为复杂,其中有 、
、 、
、 等。
等。
(1) 分子中的H—O—H键角为
分子中的H—O—H键角为 ,则
,则 分子中的H—N—H键角
分子中的H—N—H键角_____ (填“>”、“<”或“=”) 。
。
(2)请从化学键的角度解释 分子比
分子比 分子稳定的原因:
分子稳定的原因:_____ 。
(3) 的水溶液中含有
的水溶液中含有 ,
, 的空间构型为
的空间构型为_____ ,中心原子的杂化类型为_____ 。
(4)氨气溶于水时,大部分 与
与 用氢键(用“…”表示)结合形成
用氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为_____。
的结构式为_____。
 、
、 、
、 等。
等。(1)
 分子中的H—O—H键角为
分子中的H—O—H键角为 ,则
,则 分子中的H—N—H键角
分子中的H—N—H键角 。
。(2)请从化学键的角度解释
 分子比
分子比 分子稳定的原因:
分子稳定的原因:(3)
 的水溶液中含有
的水溶液中含有 ,
, 的空间构型为
的空间构型为(4)氨气溶于水时,大部分
 与
与 用氢键(用“…”表示)结合形成
用氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为_____。
的结构式为_____。A. | B. |
C. | D. |
您最近一年使用:0次
名校
解题方法
8 . 哈尔滨工业大学的李惠等人和加州大学洛杉矶分校的黄昱、段镶锋合作合成了具备超轻、高力学强度和超级隔热三大特点的氮化硼(hBNAGs)以及碳化硅( -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
(1)硅原子的价电子排布图为___________ 。B、N、O、Al的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。
① 从原子结构分析B容易与配体形成配位键的原因___________ 。
② 下列有关硼酸及其相关化合物的说法正确的是___________ (填标号)。
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
① 下列有关氨硼烷(NH3BH3)的说法中错误的是___________ (填标号)。
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷中H−N−H的键角___________ (填“>”“<”或“=”)H−B−H的键角。
 -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:(1)硅原子的价电子排布图为
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF
 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。① 从原子结构分析B容易与配体形成配位键的原因
② 下列有关硼酸及其相关化合物的说法正确的是
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
| 元素符号 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷中H−N−H的键角
您最近一年使用:0次
2023-07-06更新
|
105次组卷
|
2卷引用:甘肃省兰州市教育局第四片区2022-2023学年高二下学期期末考试化学试题
9 . 按要求填空。
(1)25℃,两种酸的电离平衡常数如下表。
向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为___________ 。
(2)有机物A的结构简式为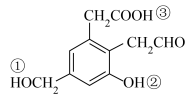 ,若取等质量的A分别与足量的Na、NaOH、H2充分反应,理论上消耗这三种物质的物质的量之比为
,若取等质量的A分别与足量的Na、NaOH、H2充分反应,理论上消耗这三种物质的物质的量之比为___________ ,有机物A中标有序号①、②、③处羟基上氢原子的活泼性由强到弱顺序为___________ (用序号表示)。
(3)有机物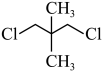 的核磁共振氢谱出现的峰面积之比为
的核磁共振氢谱出现的峰面积之比为___________ 。
(4)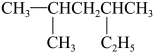 的系统命名为
的系统命名为___________ ,1分子有机物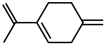 与2分子Br2发生加成反应,可以得到的产物有
与2分子Br2发生加成反应,可以得到的产物有___________ 种。
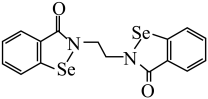
(5)乙烷硒啉是一种抗癌新药,其结构式如图:
①基态Se原子的核外电子排布式为___________ 。
②比较键角大小:气态 分子
分子___________  离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。
(1)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(2)有机物A的结构简式为
 ,若取等质量的A分别与足量的Na、NaOH、H2充分反应,理论上消耗这三种物质的物质的量之比为
,若取等质量的A分别与足量的Na、NaOH、H2充分反应,理论上消耗这三种物质的物质的量之比为(3)有机物
 的核磁共振氢谱出现的峰面积之比为
的核磁共振氢谱出现的峰面积之比为(4)
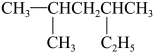 的系统命名为
的系统命名为 与2分子Br2发生加成反应,可以得到的产物有
与2分子Br2发生加成反应,可以得到的产物有(5)乙烷硒啉是一种抗癌新药,其结构式如图:

①基态Se原子的核外电子排布式为
②比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。
您最近一年使用:0次
名校
解题方法
10 . 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器中得到广泛应用。 的键角为
的键角为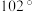 ,其沸点为
,其沸点为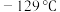 ,可在铜的催化作用U下由
,可在铜的催化作用U下由 和过量
和过量 反应得到。
反应得到。
(1)根据VSEPR理论计算可知。 的理想模型为
的理想模型为___________ 形,实际为___________ 形。
(2) 的沸点比
的沸点比 的点(
的点(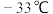 )低得多的主要原因是
)低得多的主要原因是___________ 。
(3)简述 的键角为
的键角为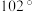 而不是
而不是 的原因
的原因___________ 。
 的键角为
的键角为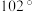 ,其沸点为
,其沸点为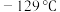 ,可在铜的催化作用U下由
,可在铜的催化作用U下由 和过量
和过量 反应得到。
反应得到。(1)根据VSEPR理论计算可知。
 的理想模型为
的理想模型为(2)
 的沸点比
的沸点比 的点(
的点(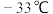 )低得多的主要原因是
)低得多的主要原因是(3)简述
 的键角为
的键角为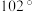 而不是
而不是 的原因
的原因
您最近一年使用:0次



