名校
解题方法
1 . 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)Cu在周期表中位于___________ 区,Cu2+价电子排布式为___________ 。
(2)邻氨基吡啶(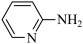 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为___________ ;1mol 中σ键的数目为
中σ键的数目为___________ 。邻氨基吡啶的铜配合物结构简式如下图所示,C原子轨道杂化类型为___________ 。
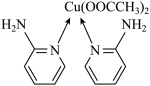
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是___________ 。
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是___________ 。
(1)Cu在周期表中位于
(2)邻氨基吡啶(
 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为 中σ键的数目为
中σ键的数目为
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是
您最近一年使用:0次
2023-07-05更新
|
192次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一下学期期末考试化学试题
名校
2 . 依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
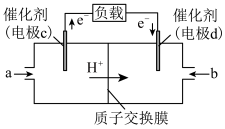
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次
解题方法
3 . 半导体材料的发展带动了科技的进步,如传统半导体Si、Ge,新型半导体GaAs、AlN、GaN等。回答下列问题:
(1)基态Ge原子的价电子排布式为______ ,与其同周期的IIIB族元素属于______ 区。
(2)根据元素周期律可判知:原子半径Al______ N(填“>”或“<”,下同),还原性As3—______ Br—。
(3)Ga、Ge、As的第一电离能由大到小的顺序为______ ;Ge、As的常见化合物有GeCl4、AsH3、AsCl5,其中呈正四面体结构的是______ 。
(4)AlN结构中只存在N-Al键,每个原子周围都满足8e—结构,AlN中______ (填“存在”或“不存在”)配位键。
(5)Si与C是同主族相邻元素,C原子之间可以形成双键、三键,但Si原子之间难以形成双键或三键,从原子结构角度分析其原因______ 。
(1)基态Ge原子的价电子排布式为
(2)根据元素周期律可判知:原子半径Al
(3)Ga、Ge、As的第一电离能由大到小的顺序为
(4)AlN结构中只存在N-Al键,每个原子周围都满足8e—结构,AlN中
(5)Si与C是同主族相邻元素,C原子之间可以形成双键、三键,但Si原子之间难以形成双键或三键,从原子结构角度分析其原因
您最近一年使用:0次
名校
解题方法
4 . Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的阴离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物中Q的杂化类型为___ ,分子中含有____ 个σ键,____ 个π键。
(2)R的氢化物分子的立体构型是____ ,R与X形成的化合物可作为一种重要的陶瓷材料,其化学式是____ 。
(3)X的常见氢化物的立体构型是____ ;键角___ ;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是____ 。
(4)Q分别与Y、Z形成的共价化合物的化学式是____ 和____ ;
(1)Q的最高价氧化物中Q的杂化类型为
(2)R的氢化物分子的立体构型是
(3)X的常见氢化物的立体构型是
(4)Q分别与Y、Z形成的共价化合物的化学式是
您最近一年使用:0次



