1 . 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,请回答:
(1)基态下Fe2+共有_____ 种不同空间运动状态的电子。
(2)Fe2+形成的配合物亚铁氰化钾K4[Fe(CN)6]又称黄血盐,可用于检验Fe3+,与CN-互为等电子体的阴离子为_________ (任写一种);含有120molσ键的K4[Fe(CN)6]的物质的量为_____ mol。
(3)H 2SO4的酸性强于H2SO3酸性的原因是_______ 。
(4)FeS2晶体的晶胞结构如图所示。在晶胞中,Fe2+位于 所形成的
所形成的______ (填“正四面体”或“正八面体”)空隙;若晶胞参数为 a nm,密度为ρg∙cm−3,阿伏加德罗常数的值为NA ,则FeS2的摩尔质量 M=_______ (用含 a、ρ、 NA的代数式表示)。

(1)基态下Fe2+共有
(2)Fe2+形成的配合物亚铁氰化钾K4[Fe(CN)6]又称黄血盐,可用于检验Fe3+,与CN-互为等电子体的阴离子为
(3)H 2SO4的酸性强于H2SO3酸性的原因是
(4)FeS2晶体的晶胞结构如图所示。在晶胞中,Fe2+位于
 所形成的
所形成的
您最近一年使用:0次
名校
解题方法
2 . NA为阿伏加德罗常数,下列说法正确的是
| A.1mol P4含有P-P键的个数为4NA |
| B.1 mol SiC中含有 C-Si键的个数为2NA |
| C.1 mol SiO2中含 Si-O 键的个数为 2NA |
| D.12g金刚石中含有C-C键的个数为 2NA |
您最近一年使用:0次
名校
解题方法
3 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 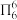 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
名校
4 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.68g三氟化硼中中心原子的价层电子对总数为3NA |
| B.40g基态氩气中含有的p轨道电子总数为6NA |
| C.78g苯中含有σ键的数目为6NA |
| D.标准状况下,22.4LHF分子中含有氢键的数目为NA |
您最近一年使用:0次
2023-04-22更新
|
131次组卷
|
3卷引用:陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题
解题方法
5 . 如图表示不同类型共价键形成时电子云重叠情况:
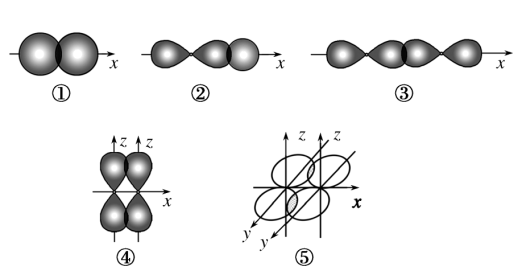
(1)其中形成的化学键属于轴对称的有_______ 。
(2)下列物质中,通过方式①化学键形成的是_______ ;通过方式②化学键形成的是_______ ;只通过方式③化学键形成的是_______ ;同时含有③、④、⑤三种方式化学键的物质是_______ 。
A. Cl2 B.HCl C.N2 D.H2
(3)甲、乙、丙三种有机物的结构如下:
甲: 乙:CH2=CH2丙:
乙:CH2=CH2丙:
①甲分子中有_______ 个σ键,_______ 个π键。
②乙分子中_______ (填“有”或“没有”)极性键,_______ (填“是”或“不是”)极性分子。
③丙分子中σ键与π键的数目之比为_______ 。

(1)其中形成的化学键属于轴对称的有
(2)下列物质中,通过方式①化学键形成的是
A. Cl2 B.HCl C.N2 D.H2
(3)甲、乙、丙三种有机物的结构如下:
甲:
 乙:CH2=CH2丙:
乙:CH2=CH2丙:
①甲分子中有
②乙分子中
③丙分子中σ键与π键的数目之比为
您最近一年使用:0次
2022-10-04更新
|
226次组卷
|
2卷引用:陕西省西安市阎良区关山中学2021-2022学年高二下学期第三次质量检测化学试题
解题方法
6 . 以NA表示阿伏加德罗常数,下列说法正确的是
| A.12 g石墨中含有σ键的个数为2NA |
| B.7.8 gNa2O2晶体中含有阴阳离子总数为0.4NA |
| C.1 mol SiO2晶体中含有2NASi-O键 |
| D.2.8 g乙烯中含π键的数目为0.1NA |
您最近一年使用:0次
名校
解题方法
7 . 设阿伏加德罗常数的值为NA,下列结论错误 的是
A.完全电解 断裂的 断裂的 键键数为4NA 键键数为4NA |
B.标准状况下,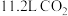 中含有的 中含有的 键键数为2NA 键键数为2NA |
C.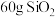 晶体中含有的Si-O键键数为4NA 晶体中含有的Si-O键键数为4NA |
D. 的水溶液中加入 的水溶液中加入 溶液,不能生成 溶液,不能生成 沉淀 沉淀 |
您最近一年使用:0次
名校
解题方法
8 . 已知吡咯中的各个原子均在同一平面内,其结构如下图所示,则下列关于吡咯的说法正确的是


| A.吡咯的分子式为C4HN |
| B.分子中含10个σ键 |
| C.分子中只有极性键 |
D.分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键中电子数,则吡咯的大π键应表示为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键中电子数,则吡咯的大π键应表示为 |
您最近一年使用:0次
2022-04-22更新
|
95次组卷
|
2卷引用:陕西省陕西师范大学附属中学2020-2021学年高二下学期期中考试化学试题
名校
解题方法
9 . 全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[ Ne]3s2 违背了
违背了_______ 。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3_______ SiCl4(填“>”或“<”),与SiCl4互为等电子体的离子为_______ (任写1种即可)。已知电负性:H>Si,则SiHCl3充分水解的化学方程式为_______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是_______ (填字母标号)。
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因_______ 。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为_______ D,该氮化钛的密度_______ g· cm-3(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
 违背了
违背了(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为

您最近一年使用:0次
2022-04-14更新
|
1930次组卷
|
11卷引用:陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题
陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(全国甲卷)广东省茂名市普通高中毕业班2022届高三下学期模拟考试化学试题北京市第二中学2022届高三下学期五月模拟考试化学试题广东省广州市第六中学2022届高三第三次模拟考试化学试题广西南宁市第二中学2021-2022学年高三下学期收网题理综化学试题(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题
名校
10 . 金刚石、石墨、 和石墨烯的结构示意图分别如图所示,下列说法不正确的是
和石墨烯的结构示意图分别如图所示,下列说法不正确的是
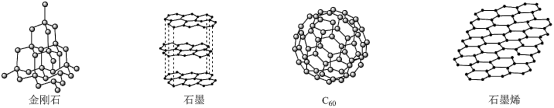
 和石墨烯的结构示意图分别如图所示,下列说法不正确的是
和石墨烯的结构示意图分别如图所示,下列说法不正确的是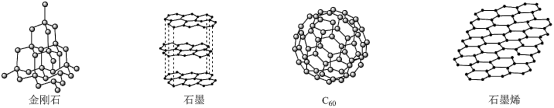
| A.等质量的金刚石和石墨晶体中含有的碳碳键数之比为4:3 |
B. 分子中含有双键的数目是30个 分子中含有双键的数目是30个 |
| C.石墨烯结构中,平均每个六元环含有2个碳原子 |
| D.从石墨中剥离石墨烯需要破坏化学键,石墨烯具有导电性 |
您最近一年使用:0次
2022-03-19更新
|
559次组卷
|
2卷引用:陕西省西安中学2021-2022学年高二下学期期中考试化学试题



