名校
解题方法
1 . 请回答下列问题。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式_________ 。
②按照核外电子排布,可把元素周期表划分为5个区, 在元素周期表中属于
在元素周期表中属于_________ 区。
(2) 是
是 的一种重要配合物。
的一种重要配合物。
①该配合物的一种配体是 ,
, 的空间结构呈
的空间结构呈_________ 形,是_________ (填“极性”或“非极性)分子。
② 的价层电子轨道表示式是
的价层电子轨道表示式是_________ 。
③ 中含有的
中含有的 键的数目为
键的数目为_________ (用 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。
④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取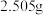 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液,_________ (补全实验操作),称量沉淀质量为_________ (精确到 ,相对分子质量
,相对分子质量 :250.5;
:250.5; :143.5) 。
:143.5) 。
(3)第ⅤA族元素及其化合物的结构和性质如下:
① 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_________ (填化学式,下同),键角由大到小的顺序为_________ 。
②某一种氮化硼晶体的立方晶胞结构如图:
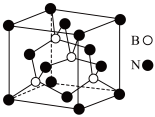
i.氮化硼 属于
属于_________ 晶体;该种氮化硼 的熔点
的熔点_________  (填>、<、=)。
(填>、<、=)。
ii.已知氮化硼 晶胞的边长为
晶胞的边长为 ,则晶胞密度为
,则晶胞密度为_________  (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式
②按照核外电子排布,可把元素周期表划分为5个区,
 在元素周期表中属于
在元素周期表中属于(2)
 是
是 的一种重要配合物。
的一种重要配合物。①该配合物的一种配体是
 ,
, 的空间结构呈
的空间结构呈②
 的价层电子轨道表示式是
的价层电子轨道表示式是③
 中含有的
中含有的 键的数目为
键的数目为 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取
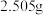 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液, ,相对分子质量
,相对分子质量 :250.5;
:250.5; :143.5) 。
:143.5) 。(3)第ⅤA族元素及其化合物的结构和性质如下:
①
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为②某一种氮化硼晶体的立方晶胞结构如图:

i.氮化硼
 属于
属于 的熔点
的熔点 (填>、<、=)。
(填>、<、=)。ii.已知氮化硼
 晶胞的边长为
晶胞的边长为 ,则晶胞密度为
,则晶胞密度为 (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
2 . 火星岩石含有大量氧化物,如Fe2O3、Al2O3,MgO、CaO、Na2O、SiO2、H2O等。
(1)表中的氧化物中偏向共价晶体的过渡晶体是____ (填化学式)。
(2)基态铁元素的原子最高能级电子云轮廓为____ 形。
(3)Al2O3与NaOH溶液反应生成的[Al(OH)4]-离子中Al的杂化类型是____ ;Al和O构成的空间构型是____ 。
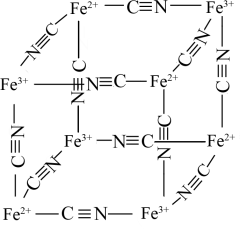
(4)4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]↓(普鲁士蓝),该反应可检验溶液中Fe3+,如图是普鲁士蓝 晶胞的结构,与CN-形成配位键的是
晶胞的结构,与CN-形成配位键的是____ (填Fe2+或Fe3+);CN-离子中σ键与π键的个数比是___ ;晶胞中与一个Fe3+距离相等的N有____ 个。
(5)一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链如图所示。其中Si原子的杂化轨道类型是____ 。

(6)写出SiCl4的电子式:____ ,H2还原气态SiCl4可制得纯硅,1100℃时每生成0.56kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___ 。
(1)表中的氧化物中偏向共价晶体的过渡晶体是
| 氧化物 | Na2O | MgO | Al2O3 | SiO2 |
| 离子键的百分数 | 62% | 50% | 41% | 33% |
(3)Al2O3与NaOH溶液反应生成的[Al(OH)4]-离子中Al的杂化类型是
(4)4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]↓(普鲁士蓝),该反应可检验溶液中Fe3+,如图是普鲁士蓝
 晶胞的结构,与CN-形成配位键的是
晶胞的结构,与CN-形成配位键的是
(5)一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链如图所示。其中Si原子的杂化轨道类型是

(6)写出SiCl4的电子式:
您最近一年使用:0次
解题方法
3 . 国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2。回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是___________ ,处于_____ 区,未成对电子数是________ 。
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是___________ , 中心原子采用的杂化类型可能是___________ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。

(3)DMF的结构是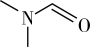 ,σ键与π键的数目比是
,σ键与π键的数目比是___________ ,其中N原子的杂化方式是___________ 。
(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因______ 。
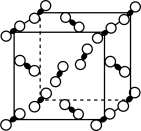
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是___________ cm。
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl
 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

您最近一年使用:0次



