解题方法
1 . 一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)在配合物K4[Fe(CN)6]中,配位体是___________ ,配位数是___________ 。
(2)新制备的Cu(OH)2可氧化乙醛,而自身还原成Cu2O,写出该反应的化学方程式:___________ ,乙醛分子中碳原子的杂化轨道类型为___________ 。1mol乙醛分子中含有 键的数目约为
键的数目约为___________ 。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有1个氧原子,其余氧原子均位于顶点,则该晶胞有___________ 个铜原子。
(3)Al晶体结构如图所示,晶体中每个Al周围等距且紧邻的Al有___________ 个。晶胞棱长为anm,密度为___________ gcm-3(NA表示阿伏加德罗常数的值)。

(1)在配合物K4[Fe(CN)6]中,配位体是
(2)新制备的Cu(OH)2可氧化乙醛,而自身还原成Cu2O,写出该反应的化学方程式:
 键的数目约为
键的数目约为(3)Al晶体结构如图所示,晶体中每个Al周围等距且紧邻的Al有

您最近一年使用:0次
解题方法
2 . 坐落在河北区的华为天津区域总部项目计划于2023年12月底竣工。石墨烯液冷散热技术系华为公司首创,所使用材料石墨烯是一种二维碳纳米材料。
I. 、金刚石、石墨的结构模型如图所示(石墨仅表示出其中的一层结构):
、金刚石、石墨的结构模型如图所示(石墨仅表示出其中的一层结构):

(1)金刚石、石墨和 三者互为___________(填序号)。
三者互为___________(填序号)。
(2) 晶体的晶体类型为
晶体的晶体类型为___________ 。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中所含有硅硅单键的数目是___________ 。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是___________ 。
II.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
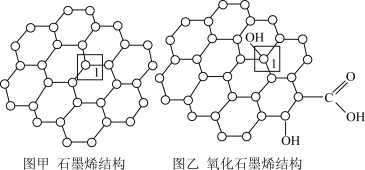

(5)图甲中,1号C与相邻C形成 键的个数为
键的个数为___________ 。
(6)图乙中,1号C的杂化方式是___________ 。
(7)若将图乙中所示的氧化石墨烯分散在 中,则氧化石墨烯中可与
中,则氧化石墨烯中可与 形成氢键的原子有
形成氢键的原子有___________ (填元素符号)。
(8)石墨烯可转化为富勒烯( ),某金属M与
),某金属M与 可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该材料的化学式为
可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该材料的化学式为___________ 。
I.
 、金刚石、石墨的结构模型如图所示(石墨仅表示出其中的一层结构):
、金刚石、石墨的结构模型如图所示(石墨仅表示出其中的一层结构):
(1)金刚石、石墨和
 三者互为___________(填序号)。
三者互为___________(填序号)。| A.同分异构体 | B.同素异形体 | C.同系物 | D.同位素 |
 晶体的晶体类型为
晶体的晶体类型为(3)晶体硅的结构跟金刚石相似,1mol晶体硅中所含有硅硅单键的数目是
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是
II.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。


(5)图甲中,1号C与相邻C形成
 键的个数为
键的个数为(6)图乙中,1号C的杂化方式是
(7)若将图乙中所示的氧化石墨烯分散在
 中,则氧化石墨烯中可与
中,则氧化石墨烯中可与 形成氢键的原子有
形成氢键的原子有(8)石墨烯可转化为富勒烯(
 ),某金属M与
),某金属M与 可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该材料的化学式为
可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该材料的化学式为
您最近一年使用:0次
解题方法
3 . 氮、磷、砷、锑为元素周期表中原子序数依次增大的同族元素。
(1)除 外,科学家还先后研究出了
外,科学家还先后研究出了 、
、 、
、 、高聚氮等氮的单质。
、高聚氮等氮的单质。 为正四面体结构,高聚氮具有空间网状结构,如图所示。
为正四面体结构,高聚氮具有空间网状结构,如图所示。

① 分子是一种
分子是一种_______ (填“极性”或“非极性”)分子。
② 的沸点
的沸点_______ (填“>”、“<”或“=”)高聚氮的沸点,原因是_______ 。
(2)热稳定性:
_______  (填“>”“<”),判断依据是
(填“>”“<”),判断依据是_______ 。
(3) 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为_______ ,C原子的杂化类型为_______ 。
(1)除
 外,科学家还先后研究出了
外,科学家还先后研究出了 、
、 、
、 、高聚氮等氮的单质。
、高聚氮等氮的单质。 为正四面体结构,高聚氮具有空间网状结构,如图所示。
为正四面体结构,高聚氮具有空间网状结构,如图所示。
①
 分子是一种
分子是一种②
 的沸点
的沸点(2)热稳定性:

 (填“>”“<”),判断依据是
(填“>”“<”),判断依据是(3)
 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为
您最近一年使用:0次
名校
解题方法
4 . 碳和硅均为元素周期表中第ⅣA族的元素,其单质和化合物有着重要应用。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式_______ ,石墨烯中C的杂化类型为_______ 。
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为_______ mol。

③石墨烯可由加热SiC晶体脱除Si的方法制得。该过程属于_______ 。
a.物理变化 b.分解反应 c.氧化还原反应
(2)SiC的晶体结构与晶体硅类似。SiC的晶体类型为_______ ,晶体中Si原子与Si-C键的数目之比为_______ 。
(3)CHCl3与SiHCl3空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:______ 。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为

③石墨烯可由加热SiC晶体脱除Si的方法制得。该过程属于
a.物理变化 b.分解反应 c.氧化还原反应
(2)SiC的晶体结构与晶体硅类似。SiC的晶体类型为
(3)CHCl3与SiHCl3空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 请回答下列问题。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式_________ 。
②按照核外电子排布,可把元素周期表划分为5个区, 在元素周期表中属于
在元素周期表中属于_________ 区。
(2) 是
是 的一种重要配合物。
的一种重要配合物。
①该配合物的一种配体是 ,
, 的空间结构呈
的空间结构呈_________ 形,是_________ (填“极性”或“非极性)分子。
② 的价层电子轨道表示式是
的价层电子轨道表示式是_________ 。
③ 中含有的
中含有的 键的数目为
键的数目为_________ (用 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。
④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取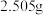 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液,_________ (补全实验操作),称量沉淀质量为_________ (精确到 ,相对分子质量
,相对分子质量 :250.5;
:250.5; :143.5) 。
:143.5) 。
(3)第ⅤA族元素及其化合物的结构和性质如下:
① 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_________ (填化学式,下同),键角由大到小的顺序为_________ 。
②某一种氮化硼晶体的立方晶胞结构如图:
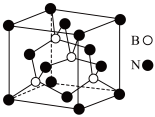
i.氮化硼 属于
属于_________ 晶体;该种氮化硼 的熔点
的熔点_________  (填>、<、=)。
(填>、<、=)。
ii.已知氮化硼 晶胞的边长为
晶胞的边长为 ,则晶胞密度为
,则晶胞密度为_________  (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式
②按照核外电子排布,可把元素周期表划分为5个区,
 在元素周期表中属于
在元素周期表中属于(2)
 是
是 的一种重要配合物。
的一种重要配合物。①该配合物的一种配体是
 ,
, 的空间结构呈
的空间结构呈②
 的价层电子轨道表示式是
的价层电子轨道表示式是③
 中含有的
中含有的 键的数目为
键的数目为 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取
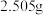 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液, ,相对分子质量
,相对分子质量 :250.5;
:250.5; :143.5) 。
:143.5) 。(3)第ⅤA族元素及其化合物的结构和性质如下:
①
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为②某一种氮化硼晶体的立方晶胞结构如图:

i.氮化硼
 属于
属于 的熔点
的熔点 (填>、<、=)。
(填>、<、=)。ii.已知氮化硼
 晶胞的边长为
晶胞的边长为 ,则晶胞密度为
,则晶胞密度为 (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
6 . 火星岩石含有大量氧化物,如Fe2O3、Al2O3,MgO、CaO、Na2O、SiO2、H2O等。
(1)表中的氧化物中偏向共价晶体的过渡晶体是____ (填化学式)。
(2)基态铁元素的原子最高能级电子云轮廓为____ 形。
(3)Al2O3与NaOH溶液反应生成的[Al(OH)4]-离子中Al的杂化类型是____ ;Al和O构成的空间构型是____ 。
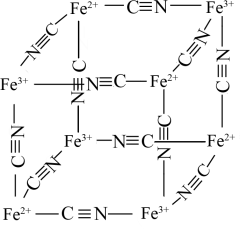
(4)4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]↓(普鲁士蓝),该反应可检验溶液中Fe3+,如图是普鲁士蓝 晶胞的结构,与CN-形成配位键的是
晶胞的结构,与CN-形成配位键的是____ (填Fe2+或Fe3+);CN-离子中σ键与π键的个数比是___ ;晶胞中与一个Fe3+距离相等的N有____ 个。
(5)一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链如图所示。其中Si原子的杂化轨道类型是____ 。

(6)写出SiCl4的电子式:____ ,H2还原气态SiCl4可制得纯硅,1100℃时每生成0.56kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___ 。
(1)表中的氧化物中偏向共价晶体的过渡晶体是
| 氧化物 | Na2O | MgO | Al2O3 | SiO2 |
| 离子键的百分数 | 62% | 50% | 41% | 33% |
(3)Al2O3与NaOH溶液反应生成的[Al(OH)4]-离子中Al的杂化类型是
(4)4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]↓(普鲁士蓝),该反应可检验溶液中Fe3+,如图是普鲁士蓝
 晶胞的结构,与CN-形成配位键的是
晶胞的结构,与CN-形成配位键的是
(5)一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链如图所示。其中Si原子的杂化轨道类型是

(6)写出SiCl4的电子式:
您最近一年使用:0次
2022·云南昆明·一模
解题方法
7 . 国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2。回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是___________ ,处于_____ 区,未成对电子数是________ 。
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是___________ , 中心原子采用的杂化类型可能是___________ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。

(3)DMF的结构是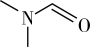 ,σ键与π键的数目比是
,σ键与π键的数目比是___________ ,其中N原子的杂化方式是___________ 。
(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因______ 。
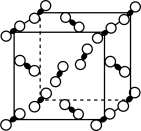
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是___________ cm。
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl
 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

您最近一年使用:0次
解题方法
8 . 亚铁氰化钾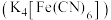 又称黄血盐,用于检验
又称黄血盐,用于检验 ,也用作实验的防结剂。回答问题:
,也用作实验的防结剂。回答问题:
(1)N的基态原子的轨道表示式(电子排布图)为______ 。
(2)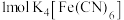 中含
中含 键的数目为
键的数目为______  ,C、N、K的第一电离能由大到小的排序为
,C、N、K的第一电离能由大到小的排序为______ 。
(3)实验室常用 检验
检验 ,生成难溶盐
,生成难溶盐 ,则反应的离子方程式为
,则反应的离子方程式为______ 。
(4)黄血盐可与高锰酸钾溶液反应: (未配平)。若有
(未配平)。若有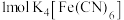 被氧化,则消耗高锰酸钾的物质的量为
被氧化,则消耗高锰酸钾的物质的量为______ , 的电子式为
的电子式为______ 。
(5)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释 的沸点高于
的沸点高于 的原因为
的原因为______ 。
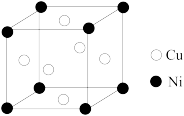
(6)某镍白铜合金的立方晶胞结构如图所示。则晶胞中铜和镍原子个数比
______ 。
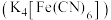 又称黄血盐,用于检验
又称黄血盐,用于检验 ,也用作实验的防结剂。回答问题:
,也用作实验的防结剂。回答问题:(1)N的基态原子的轨道表示式(电子排布图)为
(2)
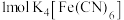 中含
中含 键的数目为
键的数目为 ,C、N、K的第一电离能由大到小的排序为
,C、N、K的第一电离能由大到小的排序为(3)实验室常用
 检验
检验 ,生成难溶盐
,生成难溶盐 ,则反应的离子方程式为
,则反应的离子方程式为(4)黄血盐可与高锰酸钾溶液反应:
 (未配平)。若有
(未配平)。若有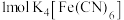 被氧化,则消耗高锰酸钾的物质的量为
被氧化,则消耗高锰酸钾的物质的量为 的电子式为
的电子式为(5)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释
 的沸点高于
的沸点高于 的原因为
的原因为(6)某镍白铜合金的立方晶胞结构如图所示。则晶胞中铜和镍原子个数比
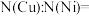

您最近一年使用:0次
2021-04-05更新
|
425次组卷
|
2卷引用:天津市部分区2021届高三第一次质量调查化学试题
解题方法
9 . 我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________ 。
(2)第一电离能N______ O(填“>”、“<”或“=”),其原因是_____________ 。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①R中两种阳离子的相同之处为_________ ,不同之处为__________ 。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________ 个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________ 。
③图中虚线代表氢键,其表示式为(NH4+)N−H…Cl、___________ 、____________ 。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
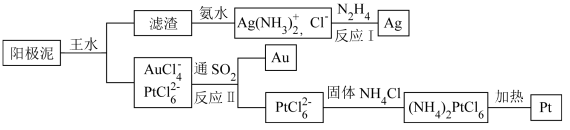
①滤渣的成分是_____________ ,(NH4)2PtCl6中配体是_______________________ 。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________ ,试写出该反应的化学方程式________ 。
(1)氮原子价层电子的轨道表达式为
(2)第一电离能N
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①R中两种阳离子的相同之处为
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为
③图中虚线代表氢键,其表示式为(NH4+)N−H…Cl、
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:

①滤渣的成分是
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是
您最近一年使用:0次
2020-06-03更新
|
177次组卷
|
2卷引用:天津市和平区2020届高三一模化学试题
解题方法
10 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________ 。
(2)Mn位于元素周期表的_____ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__ NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____ 。PO43-的空间构型是___ ,中心原子的杂化方式是______ 。
(4)PH3是_____ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______ 。
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______ nm。(用含a、M、NA的计算式表示)

(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为
(2)Mn位于元素周期表的
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是
(4)PH3是
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次



