解题方法
1 . 2020年3月29日,比亚迪发布刀片电池,该电池不但大幅提高了体积利用率,并且顺利通过了安全性能的“针刺测试”,其使用的磷酸铁锂电池的工作原理为LiFePO4 +C Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
(1)LiFePO4中基态铁粒子的核外电子排布式为_______ ,Fe原子的所有能级中能量最高的能级是_______ 。
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P三种元素中,电负性由大到小的顺序为_______ ,NH3的键角略大于PH3,从原子结构角度说明原因_______ 。
(3)磷的氯化物有两种: PCl3和 PCl5, PCl3的VSEPR模型为_______ ,其中PCl3的沸点_______ (填“大于”或“小于”)PCl5。
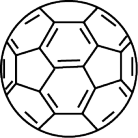
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图所示,2mol足球烯含_______ 个π键。
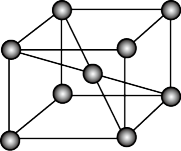
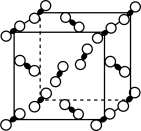
(5)锂、铁单质晶胞分别如左图、右图所示,锂、铁晶胞的配位数之比为_______ 。
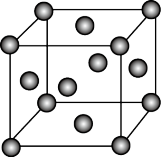
(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρg·cm-3,金刚石中C—C键的键长为_______ m(用代数式表示)。

 Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:(1)LiFePO4中基态铁粒子的核外电子排布式为
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P三种元素中,电负性由大到小的顺序为
(3)磷的氯化物有两种: PCl3和 PCl5, PCl3的VSEPR模型为
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图所示,2mol足球烯含

(5)锂、铁单质晶胞分别如左图、右图所示,锂、铁晶胞的配位数之比为


(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρg·cm-3,金刚石中C—C键的键长为

您最近半年使用:0次
2022-07-26更新
|
445次组卷
|
2卷引用:云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题
解题方法
2 . 国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2。回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是___________ ,处于_____ 区,未成对电子数是________ 。
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是___________ , 中心原子采用的杂化类型可能是___________ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。

(3)DMF的结构是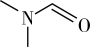 ,σ键与π键的数目比是
,σ键与π键的数目比是___________ ,其中N原子的杂化方式是___________ 。
(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因______ 。
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是___________ cm。
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl
 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

您最近半年使用:0次
名校
解题方法
3 . 过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)铂可溶于王水(浓盐酸和浓硝酸按体积比为3∶1组成的混合物),王水中含有亚硝酰氯(NOCl)。NOCl分子中各原子满足8电子稳定结构。基态氮原子的外围电子排布图为___________ ,NOCl分子中 键和
键和 键的个数比为
键的个数比为___________ 。
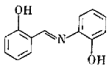
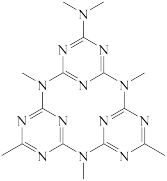
(2)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与 形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有
形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有___________ (填“sp”、“ ”或“
”或“ ”)杂化,锰试剂
”)杂化,锰试剂___________ (填“能”或“不能”)形成分子内氢键。
(3)EAN规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合EAN规则的配合物分
子结构和化学性质都较稳定。已知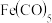 和
和 ,均符合EAN规则,性质稳定,而
,均符合EAN规则,性质稳定,而 在化学反应中表现氧化性。
在化学反应中表现氧化性。
①
___________ 。
②结合上述信息解释 在化学反应中表现氧化性的原因:
在化学反应中表现氧化性的原因:___________ 。
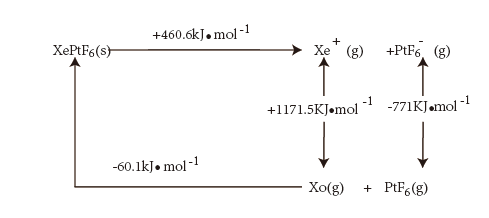
(4)氙的一种配合物六氟合铂酸氙,其化学式为 ,不溶于
,不溶于 等非极性溶剂,且加热熔化可产生
等非极性溶剂,且加热熔化可产生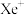 和
和 两种离子。据此可确定
两种离子。据此可确定 中化学键的类型为
中化学键的类型为___________ 。利用如图born-Habe循环计算得到Xe(g)和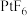 (g)合成
(g)合成 (s)的反应热。Xe原子的第一电离能为
(s)的反应热。Xe原子的第一电离能为___________  ,
, (s)的晶格能为
(s)的晶格能为___________  。
。
(5)在金属铜表面覆盖WBN型氮化硼(熔点为2967 )也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。
)也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。

①WBN型氮化硼晶体中N原子的配位数为___________ 。
②已知阿伏加德罗常数的值为 ,则WBN型氮化硼的密度为
,则WBN型氮化硼的密度为___________ 。
(1)铂可溶于王水(浓盐酸和浓硝酸按体积比为3∶1组成的混合物),王水中含有亚硝酰氯(NOCl)。NOCl分子中各原子满足8电子稳定结构。基态氮原子的外围电子排布图为
 键和
键和 键的个数比为
键的个数比为(2)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与
 形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有
形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有 ”或“
”或“ ”)杂化,锰试剂
”)杂化,锰试剂
(3)EAN规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合EAN规则的配合物分
子结构和化学性质都较稳定。已知
 和
和 ,均符合EAN规则,性质稳定,而
,均符合EAN规则,性质稳定,而 在化学反应中表现氧化性。
在化学反应中表现氧化性。①

②结合上述信息解释
 在化学反应中表现氧化性的原因:
在化学反应中表现氧化性的原因:(4)氙的一种配合物六氟合铂酸氙,其化学式为
 ,不溶于
,不溶于 等非极性溶剂,且加热熔化可产生
等非极性溶剂,且加热熔化可产生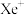 和
和 两种离子。据此可确定
两种离子。据此可确定 中化学键的类型为
中化学键的类型为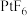 (g)合成
(g)合成 (s)的反应热。Xe原子的第一电离能为
(s)的反应热。Xe原子的第一电离能为 ,
, (s)的晶格能为
(s)的晶格能为 。
。
(5)在金属铜表面覆盖WBN型氮化硼(熔点为2967
 )也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。
)也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。
①WBN型氮化硼晶体中N原子的配位数为
②已知阿伏加德罗常数的值为
 ,则WBN型氮化硼的密度为
,则WBN型氮化硼的密度为
您最近半年使用:0次
解题方法
4 . 2021年,我国学者研究发现将FeNi层状双氢氧化物负载到g—C3N4纳米片上,可以有效提高光催化还原CO2生成CH3OH的产率。回答下列问题:
(1)基态Fe原子的价层电子排布式是______ 。
(2)CH3OH的沸点高于CO2的原因是______ 。
(3)C、N、O的第一电离能大小顺序为______ 。
(4)已知:孤电子对与成键电子对之间的排斥力大于成键电子对与成键电子对之间的排斥力。NH3可以与Ni2+形成配离子[Ni(NH3)4]2+,该离子中的H—N—H键角______ (填“大于”、“小于”或“等于”)NH3中的H—N—H键角。[Ni(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,则[Ni(NH3)4]2+的立体构型是______ 。
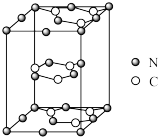
(5)一种石墨相g—C3N4的单层平面结构和晶体结构如图所示:
①石墨相g—C3N4中C的杂化方式是______ ,1molg—C3N4中的σ键的数目是______ ,g—C3N4______ (填“是”或“否”)具有导电性。
②已知:如图的中间层原子均在晶胞内部,晶胞的密度是ρg▪cm-3,晶胞的体积是Vpm3,则阿伏加德罗常数NA=______ 。
(1)基态Fe原子的价层电子排布式是
(2)CH3OH的沸点高于CO2的原因是
(3)C、N、O的第一电离能大小顺序为
(4)已知:孤电子对与成键电子对之间的排斥力大于成键电子对与成键电子对之间的排斥力。NH3可以与Ni2+形成配离子[Ni(NH3)4]2+,该离子中的H—N—H键角
(5)一种石墨相g—C3N4的单层平面结构和晶体结构如图所示:

①石墨相g—C3N4中C的杂化方式是
②已知:如图的中间层原子均在晶胞内部,晶胞的密度是ρg▪cm-3,晶胞的体积是Vpm3,则阿伏加德罗常数NA=

您最近半年使用:0次
5 . 亚铁氰化钾(K4[Fe(CN)6])是重要的化工原料和食品添加剂,又称黄血盐。黄血盐溶液与稀硫酸加热时发生反应:K4[Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
(1)写出基态Fe2+的核外电子排布式______ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和______ 。:1mol K4[Fe(CN)6]中含有σ键的数目为_____ NA。
(3)(NH4)2SO4中N原子的杂化方式为______ ;N和O相比,第一电离能更大的是______ ,电负性更大的是______ 。
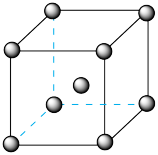
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为______ ,钠、钾相比,熔点更高的是______ ,原因是______ 。已知铁的原子半径为r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁的密度为______ g·cm-3。
 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:(1)写出基态Fe2+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)(NH4)2SO4中N原子的杂化方式为
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为

您最近半年使用:0次
6 . 自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________ ,砷属于________ 区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为___________________________ 。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如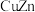 ,
,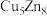 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能________ (填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是________ ,与Ti形成配位键的配体是________ , 该配合物中含有
该配合物中含有 键的数目为
键的数目为________ 。
(5) 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为:________ ;与 互为等电子体的分子有:
互为等电子体的分子有:___________________ (填分子式)。
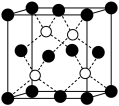
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________  (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
(1)请写出Fe的基态原子核外电子排布式
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |  |  |  |  |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(3)锌化铜是一种金属互化物,其化学式有多种形式,如
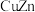 ,
,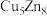 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能(4)用锌还原
 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是 该配合物中含有
该配合物中含有 键的数目为
键的数目为(5)
 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为: 互为等电子体的分子有:
互为等电子体的分子有:(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示
 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ= (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
您最近半年使用:0次
解题方法
7 . 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为_____________ 、________________ 。
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?_________ ,阐述理由:________________________________________________________________________ 。C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有_____ 个。
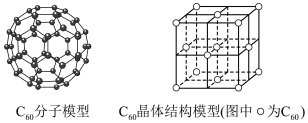
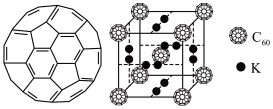
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为_________ ;1 mol C60分子中σ键的数目为________ 。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________ 。
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______ 个。
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:________________________________________________________________________ 。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?

(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为

(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:
您最近半年使用:0次
2019-09-19更新
|
142次组卷
|
2卷引用:云南省弥勒市第四中学2020届高三上学期开学考试化学试题
名校
8 . A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为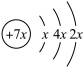 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________ ,B________ ,C________ ,D________ 。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________ ,碱性最强的是__________ 。
(3)用元素符号表示D所在周期第一电离能最大的元素是________ ,电负性(除稀有气体外)最大的元素是_________ 。
(4)E元素原子的核电荷数是_________ ,E元素在周期表的第_______ 周期第_______ 族,在________ 区。
(5)写出D元素原子构成单质的电子式___________ ,该分子中有_______ 个σ键,_______ 个π键。
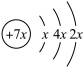 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期第一电离能最大的元素是
(4)E元素原子的核电荷数是
(5)写出D元素原子构成单质的电子式
您最近半年使用:0次
2019-08-13更新
|
210次组卷
|
8卷引用:云南省曲靖市沾益二中2017-2018学年高二下学期期末考试化学试题
9 . 氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。
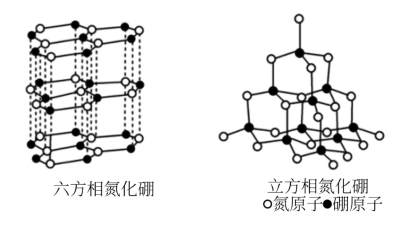
⑴基态硼原子的电子排布式为______________________________ 。
⑵关于这两种晶体的说法,正确的是_________________ (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________ ,其结构与石墨相似却不导电,原因是______________________________ 。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________ 。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________ 。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________ mol配位键。

⑴基态硼原子的电子排布式为
⑵关于这两种晶体的说法,正确的是
a.立方相氮化硼含有σ键和π键,所以硬度大b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有
您最近半年使用:0次
2019-01-30更新
|
1803次组卷
|
8卷引用:2014-2015云南德宏州芒市第一中学高二下学期期中化学试卷
解题方法
10 . [化学——选修3:物质结构与性质]
金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为

回答下列问题
(1)钼位于元素周期表的位置是__________ ,基态Mo原子核外有_________ 种不同运动状态的电子,其中核外电子占据最高能层的符号是______________ 。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。O、N、S的第一电离能由大到小的顺序________________ ,H2S中心原子的杂化轨道类型为____________ 。
(3)MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是_________ 。
(4)Mo能与CO形成Mo(CO)6的配合物,其中Mo的化合价为_________ ,其配体分子与N2具有相似的化学结构,则该配体分子中σ键与π键数目之比为_________ 。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________ 堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为rpm,NA表示阿伏伽德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________ (用含有ρ、r、NA、M的代数式表示)。
金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为

回答下列问题
(1)钼位于元素周期表的位置是
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。O、N、S的第一电离能由大到小的顺序
(3)MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
(4)Mo能与CO形成Mo(CO)6的配合物,其中Mo的化合价为
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为

您最近半年使用:0次



