1 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________ 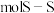 键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
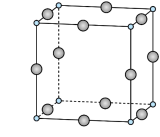
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有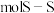 键。
键。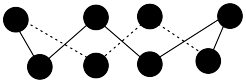
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: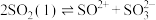 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
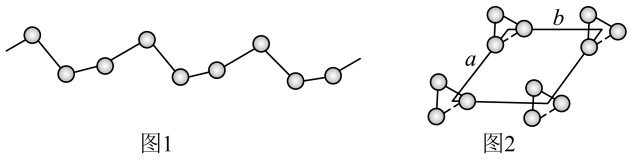
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中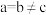 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则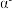 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
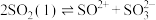 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是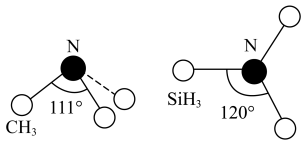
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中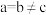 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
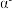 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
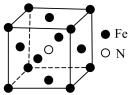
3 . 洲际弹道导弹DF—31A的制造材料中包含了Fe、Cr、Ni、C等多种元素。
(1)基态铁原子的价电子排布式为___________ ,Cr的未成对电子个数___________ ,Ni位于周期表的___________ 区。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8,其结构分别如图1、图2所示,

则Fe(CO)5中σ键与π键的个数比___________ ,图2中C的杂化方式有___________ ,形成上述两种化合物的四种元素中电负性最大的是___________ (填元素符号),写出一种与CO互为等电子体的分子___________ 。
(3)铁与氮形成的化合物的立方晶胞结构如图所示,N位于有Fe构成的___________ 的体心(填“正四面体”或“八面体”或“立方体”),若晶体密度为b ,则顶点Fe与N的距离为
,则顶点Fe与N的距离为__________ pm。(用含NA、b的代数式表示,NA为阿伏加德罗常数的值)
(1)基态铁原子的价电子排布式为
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8,其结构分别如图1、图2所示,

则Fe(CO)5中σ键与π键的个数比
(3)铁与氮形成的化合物的立方晶胞结构如图所示,N位于有Fe构成的
 ,则顶点Fe与N的距离为
,则顶点Fe与N的距离为
您最近一年使用:0次
名校
解题方法
4 . 锗(Ge)、碲化镉(CdTe)等是优良的半导体材料。回答下列问题:
(1)Ge在元素周期表中的位置___________ ,Ge的逐级电离能I4≪I5的原因是___________ 。
(2)经X射线衍射实验证明在碲酸( )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为___________ 。
(3)锗可以形成无机化合物 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为___________ ,锗也可以形成类似于烷烃结构的 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为___________ , 该分子中含有的
该分子中含有的 键数目为
键数目为___________ 。
(4)锗的氯化物 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是___________ , 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有___________ 个。
(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为___________ 空隙(填几何构型名称),若CdTe的摩尔质量为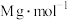 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离___________ nm。(用含M、 、
、 的代数式表示)
的代数式表示)

(1)Ge在元素周期表中的位置
(2)经X射线衍射实验证明在碲酸(
 )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为(3)锗可以形成无机化合物
 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为 该分子中含有的
该分子中含有的 键数目为
键数目为(4)锗的氯化物
 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为
 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
5 . 二茂铁( )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1) 在周期表中的
在周期表中的___________ 区,受热后 的1个
的1个 电子会跃迁至
电子会跃迁至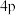 轨道,写出
轨道,写出 的该激发态电子排布式:
的该激发态电子排布式:
___________ 。
(2)铁系元素能与 形成
形成 等金属羰基化合物,已知室温下
等金属羰基化合物,已知室温下 为浅黄色液体,沸点为
为浅黄色液体,沸点为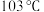 ,则
,则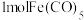 分子中含有
分子中含有___________  键,
键, 中含有的化学键类型包括
中含有的化学键类型包括___________ 。
A.离子键 B.极性共价键 C.配位键 D.金属键
(3)二茂铁的衍生物可和 等微粒产生静电作用,
等微粒产生静电作用, 和
和 的电负性由大到小的顺序为
的电负性由大到小的顺序为___________ ; 中氧原子的杂化方式为
中氧原子的杂化方式为___________ , 空间构型为
空间构型为___________ 。
(4)石墨烯的结构如图甲所示,二维结构内有大量碳六元环相连,每个碳六元环类似于苯环(但无H原子相连),石墨烯的某种氧化物的结构如图乙所示,该物质易溶于水,而石墨烯难溶于水,易溶于非极性溶剂。解释石墨烯及其氧化物的溶解性差异的原因:___________ 。

(5)石墨烷是石墨烯与 发生加成反应的产物,完全氢化的石墨烷具有
发生加成反应的产物,完全氢化的石墨烷具有___________ (填“导电性”“绝缘性”或“半导体性”)。
(6)石墨烯可作电池材料。某锂离子电池的负极材料是将 嵌入到两层石墨烯层中间,石墨烯层间距为
嵌入到两层石墨烯层中间,石墨烯层间距为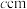 ,其晶胞结构如图所示。其中一个晶胞的质量m=
,其晶胞结构如图所示。其中一个晶胞的质量m=___________ g(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)
 在周期表中的
在周期表中的 的1个
的1个 电子会跃迁至
电子会跃迁至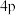 轨道,写出
轨道,写出 的该激发态电子排布式:
的该激发态电子排布式:
(2)铁系元素能与
 形成
形成 等金属羰基化合物,已知室温下
等金属羰基化合物,已知室温下 为浅黄色液体,沸点为
为浅黄色液体,沸点为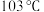 ,则
,则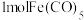 分子中含有
分子中含有 键,
键, 中含有的化学键类型包括
中含有的化学键类型包括A.离子键 B.极性共价键 C.配位键 D.金属键
(3)二茂铁的衍生物可和
 等微粒产生静电作用,
等微粒产生静电作用, 和
和 的电负性由大到小的顺序为
的电负性由大到小的顺序为 中氧原子的杂化方式为
中氧原子的杂化方式为 空间构型为
空间构型为(4)石墨烯的结构如图甲所示,二维结构内有大量碳六元环相连,每个碳六元环类似于苯环(但无H原子相连),石墨烯的某种氧化物的结构如图乙所示,该物质易溶于水,而石墨烯难溶于水,易溶于非极性溶剂。解释石墨烯及其氧化物的溶解性差异的原因:

(5)石墨烷是石墨烯与
 发生加成反应的产物,完全氢化的石墨烷具有
发生加成反应的产物,完全氢化的石墨烷具有(6)石墨烯可作电池材料。某锂离子电池的负极材料是将
 嵌入到两层石墨烯层中间,石墨烯层间距为
嵌入到两层石墨烯层中间,石墨烯层间距为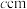 ,其晶胞结构如图所示。其中一个晶胞的质量m=
,其晶胞结构如图所示。其中一个晶胞的质量m= 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
6 . 完成下列问题
(1)蓝矾(CuSO4 ·5H2O)的结构如图所示:

SO 的立体构型是
的立体构型是___________ ,其中S原子的杂化轨道类型是___________ ;基态O原子的价电子排布图为___________ ;
(2)气态三氧化硫以单分子形式存在,其分子的立体构型为___________ 形;将纯液态SO3冷却到289. 8 K时凝固得到固体,其结构如图,固体三氧化硫中S原子的杂化轨道类型为___________ 。

(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为___________ ,SnBr2分子中的键角___________ 120°(填“>”“<”或“=”)。
(5)元素A是形成有机物的主要元素,下列分子中碳原子采取sp和sp3杂化方式的是___________ 。
A. B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
(1)蓝矾(CuSO4 ·5H2O)的结构如图所示:

SO
 的立体构型是
的立体构型是(2)气态三氧化硫以单分子形式存在,其分子的立体构型为

(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为
(5)元素A是形成有机物的主要元素,下列分子中碳原子采取sp和sp3杂化方式的是
A.
 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
您最近一年使用:0次
名校
解题方法
7 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。

(1)碳族元素位于周期表__________ 区,基态锗原子外围电子的轨道表示式为__________ 。
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 、
、 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是____________ 。
(3)金刚石(甲)、石墨(乙)、 (丙)的结构如图所示:
(丙)的结构如图所示:

①12g金刚石和石墨中含有的 键数目之比为
键数目之比为__________ 。
②金刚石的熔点高于 ,但低于石墨,原因是
,但低于石墨,原因是__________ 。
③ 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是__________ 。
A. B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为_________ ,其结构与石墨相似却不导电,原因是_____________ ,阿伏加德罗常数
__________ 。(用含a、k、ρ的式子表示)。


(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 、
、 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是(3)金刚石(甲)、石墨(乙)、
 (丙)的结构如图所示:
(丙)的结构如图所示:
①12g金刚石和石墨中含有的
 键数目之比为
键数目之比为②金刚石的熔点高于
 ,但低于石墨,原因是
,但低于石墨,原因是③
 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是A.
 B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内
 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为

您最近一年使用:0次
8 . 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)基态Cu原子的价电子排布式为_______ ;在周期表中,Cu元素属于_______ 区。
(2)往硫酸铜溶液中加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,写出沉淀溶解的离子方程式:_______ 。
(3)1mol[Cu(H2O)4]2+中含有σ键的数目为_______ 。
(4)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______ ,其结构可用示意图表示为_______ 。
(1)基态Cu原子的价电子排布式为
(2)往硫酸铜溶液中加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,写出沉淀溶解的离子方程式:
(3)1mol[Cu(H2O)4]2+中含有σ键的数目为
(4)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
您最近一年使用:0次
9 . 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的核外电子排布式为_______ ,其中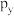 原子轨道上的电子数为
原子轨道上的电子数为_______ 个。
(2) 的配合物有多种。在
的配合物有多种。在 和
和 三种微粒的配体中,所含原子电负性由大到小的排序为
三种微粒的配体中,所含原子电负性由大到小的排序为_______ ; 含有
含有_______ 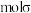 键;
键;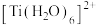 的配体中提供孤电子对的原子是
的配体中提供孤电子对的原子是_______ ; 中
中 的化合价是
的化合价是_______ ; 的球棍结构如图,
的球棍结构如图, 的配位数是
的配位数是_______ 。

(1)基态钛原子的核外电子排布式为
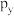 原子轨道上的电子数为
原子轨道上的电子数为(2)
 的配合物有多种。在
的配合物有多种。在 和
和 三种微粒的配体中,所含原子电负性由大到小的排序为
三种微粒的配体中,所含原子电负性由大到小的排序为 含有
含有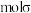 键;
键;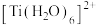 的配体中提供孤电子对的原子是
的配体中提供孤电子对的原子是 中
中 的化合价是
的化合价是 的球棍结构如图,
的球棍结构如图, 的配位数是
的配位数是
您最近一年使用:0次
解题方法
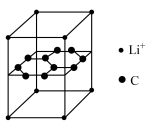
10 . 2020年12月17日,我国的嫦娥五号返回器携带月球样品,在内蒙古预定区域安全着陆。经科学家分析,发现月球土壤中富含有He、O、Si、 Fe、 Mg、Ca、Mn、Ti、Al、Au、Ag、 Pb、 Zn、 Cu等元素。
(1)使用3He的热核反应堆没有中子产生,故使用3He作为能源时,不会产生辐射。写出He的电子排布图_______ 。
(2)溶液中Fe3+比Fe2+更稳定的原因是_______ 。
(3)金属Ca和Mn属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点沸点等都比金属Mn低,其原因是_______ 。
(4)向Cu(OH)2悬浊液中通入NH3,蓝色沉淀溶解,溶液变为深蓝色,发生了如下反应:Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—,NH3分子中N的杂化类型为_______ , 比较NH3和[Cu(NH3)4]2+中H—N—H 键角的大小: NH3_______ [Cu(NH3)4]2+ (填“>”或“<”),1mol [Cu(NH3)4]2+中σ键的数目为_______ NA。
(5)CaTiO3的晶胞如图所示,Ti4+的配位数是_______ ,若Ca2+位于晶胞顶点,则O2-位于_______ 位置,若晶胞参数为anm,则晶体密度为_______ g·cm-3 (列出计算式,阿伏加德罗常数用NA表示)。

(1)使用3He的热核反应堆没有中子产生,故使用3He作为能源时,不会产生辐射。写出He的电子排布图
(2)溶液中Fe3+比Fe2+更稳定的原因是
(3)金属Ca和Mn属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点沸点等都比金属Mn低,其原因是
(4)向Cu(OH)2悬浊液中通入NH3,蓝色沉淀溶解,溶液变为深蓝色,发生了如下反应:Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—,NH3分子中N的杂化类型为
(5)CaTiO3的晶胞如图所示,Ti4+的配位数是

您最近一年使用:0次



