名校
解题方法
1 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载。锌及其化合物在生产、生活中有着重要的用途。锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外电子共有____ 种空间运动状态。
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是____ (填字母)。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。其中CO 的空间构型为
的空间构型为____ (用文字描述)。与CO 互为等电子体的分子是
互为等电子体的分子是____ (写一种即可)。
(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为____ ,其中C原子的杂化方式为____ 。
②1mol葡萄糖酸分子中含有____ molσ键。葡萄糖酸的熔点小于葡萄糖酸锌的熔点原因是____ 。
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的____ 空隙中;
②六方ZnS的晶体密度为____ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)基态Zn原子核外电子共有
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 的空间构型为
的空间构型为 互为等电子体的分子是
互为等电子体的分子是(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为
②1mol葡萄糖酸分子中含有
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的
②六方ZnS的晶体密度为
您最近一年使用:0次
2022-05-24更新
|
546次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2024届高三上学期一诊模拟考试理综化学试题
名校
2 . 中科院大连物化所成功利用具有尖晶石结构的Co3O4电催化剂电解水。
(1)Co在周期表中的位置是____ ,基态Co的电子占据的最高能层符号为____ 。
(2)钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为____ ,N的I1(第一电离能)大于O的I1,其原因是____ ;自由基是指含单电子的基团,1mol—COOH(羧基自由基)中存在____ molσ键和____ molπ键。

(3)EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为____ ,甲醛分子的空间构型为____ 。
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为____ ,Co总的空隙填充率为____ ,如果晶胞边长为anm,Co3O4的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为____ g/cm3(列出计算式)。

(1)Co在周期表中的位置是
(2)钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为

(3)EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为

您最近一年使用:0次
2022-03-26更新
|
383次组卷
|
3卷引用:四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
名校
解题方法
3 . 有下列8种晶体:A.水晶B.白磷C.冰醋酸D.固态氩E.氯化铵F.铝G.金刚石H.烧碱。用序号回答下列问题:
(1)含有非极性键的原子晶体是_______ ;属于分子晶体的单质是_______ ;含有离子键、共价键、配位键的化合物是_______ ;受热熔化,需克服共价键的是_______ 。
(2)在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中的氧原子以配位键形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是_______ 。
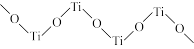
(3)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图,化学式为_______
(4)氨硼烷是一种特殊的化合物,分子式为NH3BH3.氨硼烷在催化剂作用下水解释放出氢气: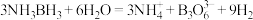 。
。 的结构如图。回答下列问题:
的结构如图。回答下列问题:

①请写出氧原子价电子轨道表达式_______ 。
②NH3BH3晶体中含有的微粒间作用力有_______ (填标号)。
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
③已知钛的一种常见化合物是 。1mol该物质中含有σ键的数目为
。1mol该物质中含有σ键的数目为_______
(5)图象是NaCl、CsCl、ZnS等离子晶体结构图或者是从其中分割出来的部分结构图。其中属于NaCl的晶体结构的图是_______
(1)含有非极性键的原子晶体是
(2)在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中的氧原子以配位键形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是
(3)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图,化学式为

(4)氨硼烷是一种特殊的化合物,分子式为NH3BH3.氨硼烷在催化剂作用下水解释放出氢气:
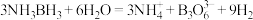 。
。 的结构如图。回答下列问题:
的结构如图。回答下列问题:
①请写出氧原子价电子轨道表达式
②NH3BH3晶体中含有的微粒间作用力有
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
③已知钛的一种常见化合物是
 。1mol该物质中含有σ键的数目为
。1mol该物质中含有σ键的数目为(5)图象是NaCl、CsCl、ZnS等离子晶体结构图或者是从其中分割出来的部分结构图。其中属于NaCl的晶体结构的图是_______
A. | B. | C.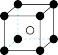 | D.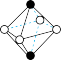 |
您最近一年使用:0次
名校
解题方法
4 . 金刚石、石墨、二氧化碳、氯化铯、氯化钠的结构模型如图所示(石墨仅表示出其中的一层结构):

(1)石墨属于_______ 晶体,金刚石与石墨互为_______ ;
(2)金刚石晶体结构中最小的环为六元环,在六元环中最多有_______ 个原子共平面,平均每个六元环占有的碳原子数是_______ ;
(3)1mol 石墨中含C-C键的数目为:_______ (用含NA的式子表示);
(4)CO2分子晶体中,每个CO2分子周围有_______ 个与之紧邻且等距的CO2分子。
(5)CsCl晶体中每个Cl-周围紧邻且等距的Cs+数目为_______ 。
(6)NaCl晶体中Na+的配位数为_______ ,Na+周围紧邻且等距的Cl-形成的空间构型为_______ 。

(1)石墨属于
(2)金刚石晶体结构中最小的环为六元环,在六元环中最多有
(3)1mol 石墨中含C-C键的数目为:
(4)CO2分子晶体中,每个CO2分子周围有
(5)CsCl晶体中每个Cl-周围紧邻且等距的Cs+数目为
(6)NaCl晶体中Na+的配位数为
您最近一年使用:0次
名校
解题方法
5 . 东晋《华阳国志·南中志》卷四中关于白铜的记载——云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni基态原子的电子排布式为___________ ;它在元素周期表中的位置___________ 。
(2)单质铜及镍都是由___________ 键形成的晶体;元素铜与镍的第二电离能分别为:Icu=1958kJ•mol-1、INi=1753kJ•mol-1,Icu>INi的原因是___________ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
2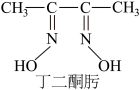 +Ni2+→
+Ni2+→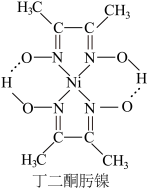 ↓+2H+
↓+2H+
①1mol丁二酮肟分子中含有σ键的数目为___________ mol。
②丁二酮肟镍分子中碳原子的杂化轨道类型为___________ 。
(4)Ni的晶胞结构如图所示,镍晶体配位数目是___________ ;若Ni的原子半径为dpm,Ni的密度计算表达式是___________ g/cm3(Ni的相对原子量用Mr表示)。
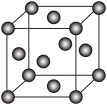 (Ni的晶胞结构)
(Ni的晶胞结构)
(1)Ni基态原子的电子排布式为
(2)单质铜及镍都是由
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
2
 +Ni2+→
+Ni2+→ ↓+2H+
↓+2H+①1mol丁二酮肟分子中含有σ键的数目为
②丁二酮肟镍分子中碳原子的杂化轨道类型为
(4)Ni的晶胞结构如图所示,镍晶体配位数目是
 (Ni的晶胞结构)
(Ni的晶胞结构)
您最近一年使用:0次
解题方法
6 . 哈萨克斯坦是“丝绸之路”的一个重要节点,其境内有丰富的铬、镍、钼矿。设NA表示阿伏加德罗常数,回答下列问题:
(1)基态Cr原子的价电子排布图为_______ 。
(2)Cr的一种配合物结构如图1所示。

①阴离子 的空间构型为
的空间构型为_______ ,写出一种与之互为等电子体的离子_______ 。
②标注“1”、“2”的碳原子的杂化类型分别为_______ 、_______ 。
③基态氮原子的第一电离能大于基态氧原子,其原因是_______ 。
(3)1 mol[Ni(NH3)4]2+中含有的σ键数目为_______ 。
(4)已知:钼的晶胞如图2所示。

①下列晶体的原子堆积方式与钼晶体的相同的是_______ (填字母)。
A.Cu B.K C.金刚石D.氯化钠
②已知钼晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,晶体中距离最近的Mo原子核之间的距离为_______ pm。
(1)基态Cr原子的价电子排布图为
(2)Cr的一种配合物结构如图1所示。

①阴离子
 的空间构型为
的空间构型为②标注“1”、“2”的碳原子的杂化类型分别为
③基态氮原子的第一电离能大于基态氧原子,其原因是
(3)1 mol[Ni(NH3)4]2+中含有的σ键数目为
(4)已知:钼的晶胞如图2所示。

①下列晶体的原子堆积方式与钼晶体的相同的是
A.Cu B.K C.金刚石D.氯化钠
②已知钼晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,晶体中距离最近的Mo原子核之间的距离为
您最近一年使用:0次
名校
7 . I.A、B、C、D、E 为短周期元素且它们的原子序数依次增大,A 的核外电子总数与其周期数相同;其中D原子的 L电子层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的 L 电子层中未成对电子数与D相同,但有空轨道;D与E同族,请回答下列问题:
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的电子式为____________ ,A分别与 B、C、D形成的共价化合物中既含有极性共价键,又含有非极性共价键的化合物是____________________ (填化学式,任意写出两种)。
(2)B的一种氢化物的相对分子质量是 26,其分子中σ键和π键的数目之比为____________ 。
(3)常温下,相同c(H+)的H2E溶液和硫酸溶液,稀释相同的倍数后的c(H+)前者与后者的关系_________ 。(“大于”、“小于”、“相等”)
Ⅱ.(1)在某温度(T ℃)的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x 与y 关系如图所示。

该温度下,水的离子积为_____ ,T ℃_______ 25℃(填“大于”“小于”或“等于”)。
(2)某温度下,纯水的c(H+)=2.0×10-7mol·L-1。在此温度下,某溶液中由水电离出的c(H+)=4.0×10-13 mol·L-1,则该溶液的pH可能是___________ 。(lg4≈0.6)
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的电子式为
(2)B的一种氢化物的相对分子质量是 26,其分子中σ键和π键的数目之比为
(3)常温下,相同c(H+)的H2E溶液和硫酸溶液,稀释相同的倍数后的c(H+)前者与后者的关系
Ⅱ.(1)在某温度(T ℃)的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x 与y 关系如图所示。

该温度下,水的离子积为
(2)某温度下,纯水的c(H+)=2.0×10-7mol·L-1。在此温度下,某溶液中由水电离出的c(H+)=4.0×10-13 mol·L-1,则该溶液的pH可能是
您最近一年使用:0次
解题方法
8 . 贝壳、珍珠、方解石等主要成分均含有CaCO3,回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧碳酸钙时的焰色为_______ (填标号)。
A 黄色 B 红色 C 紫色 D 绿色
(2)CaCO3中三种元素第一电离能由小到大的顺序是__________ 。CaCO3中的化学键除了σ键外,还存在_________________ 。
(3)关于CO2和CO32-的下列说法正确的是__________ 。
a 两种微粒价层电子对数相同 b 两种微粒的中心原子均无孤电子对
c 键角:CO2>CO32- d 两种微粒的中心原子杂化方式相同
(4)难溶碳酸盐易分解,CaCO3、BaCO3热分解温度更高的是_____ ,原因是______ 。
(5)方解石的菱面体结构如图1,沿三次轴的俯视图为正六边形。方解石的六方晶胞结构如图2,晶胞底面为平行四边形,其较小夹角为60°,边长为a nm,晶胞高为c nm。

A点在俯视图中为a,则B点在俯视图中的位置为_________ (填字母)。方解石的六方晶胞中,Ca2+和CO32-个数比为___________ ;若阿伏加 德罗常数为NA,则该方解石的密度为________ g/cm3(列出计算式)。
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧碳酸钙时的焰色为
A 黄色 B 红色 C 紫色 D 绿色
(2)CaCO3中三种元素第一电离能由小到大的顺序是
(3)关于CO2和CO32-的下列说法正确的是
a 两种微粒价层电子对数相同 b 两种微粒的中心原子均无孤电子对
c 键角:CO2>CO32- d 两种微粒的中心原子杂化方式相同
(4)难溶碳酸盐易分解,CaCO3、BaCO3热分解温度更高的是
(5)方解石的菱面体结构如图1,沿三次轴的俯视图为正六边形。方解石的六方晶胞结构如图2,晶胞底面为平行四边形,其较小夹角为60°,边长为a nm,晶胞高为c nm。

A点在俯视图中为a,则B点在俯视图中的位置为
您最近一年使用:0次
名校
解题方法
9 . Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为____ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____ ;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____ 。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____ 。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA的代数式表示)。

(1)基态Ni原子价层电子的排布式为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的

您最近一年使用:0次
2020-04-14更新
|
360次组卷
|
3卷引用:四川省德阳市2020届高三“二诊”考试(全国III)理综化学试题
名校
10 . C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)
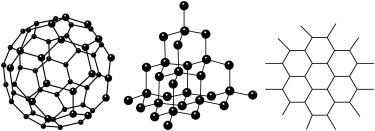
(1)C60、金刚石和石墨三者的关系互为_________
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于__________ 晶体(填“离子”、“原子”或“分子”)。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅的单键的数目约是________ NA个。二氧化硅的结构相当于在硅晶体结构中每个硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅氧原子形成的最小环上氧原子的数目是__________ 。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是__________ 。

(1)C60、金刚石和石墨三者的关系互为
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅的单键的数目约是
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是
您最近一年使用:0次



