1 . 金属钛(Ti)重量轻、强度高、抗腐蚀能力,在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
(1)基态Ti原子的价电子轨道表示式:______ 。
(2) 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
Ⅰ.

Ⅱ.

已知: 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①
______ 。
②碳氯化反应过程中CO和 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是______ 。 生成CO反应为放热反应
生成CO反应为放热反应
B.升高温度, 平衡转化率减小
平衡转化率减小
C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示 晶胞中
晶胞中 位于
位于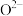 所构成的正八面体的体心,则
所构成的正八面体的体心,则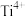 的配位数是6
的配位数是6
③碳氯化法中生成CO比生成 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是______ 。
(3)经光谱分析在碳氯化反应中有光气( )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: 含有
含有______ 个σ键,决速步骤的反应方程式为______ 。
(4)在 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数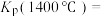
______ Pa。
②图中显示,在200℃平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是______ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。(1)基态Ti原子的价电子轨道表示式:
(2)
 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。Ⅰ.


Ⅱ.


已知:
 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①

②碳氯化反应过程中CO和
 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是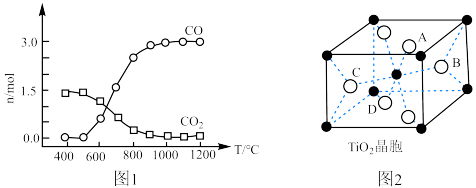
 生成CO反应为放热反应
生成CO反应为放热反应B.升高温度,
 平衡转化率减小
平衡转化率减小C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示
 晶胞中
晶胞中 位于
位于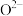 所构成的正八面体的体心,则
所构成的正八面体的体心,则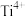 的配位数是6
的配位数是6③碳氯化法中生成CO比生成
 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是(3)经光谱分析在碳氯化反应中有光气(
 )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: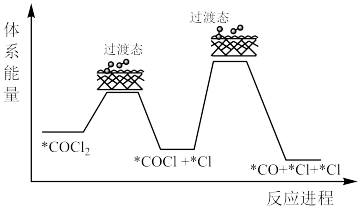
 含有
含有(4)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
 的平衡常数
的平衡常数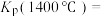
②图中显示,在200℃平衡时
 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
2024-05-10更新
|
442次组卷
|
2卷引用:河北省重点高中2023-2024学年高三5月高考模拟化学试题(一)
名校
解题方法
2 . 氯苯吡脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
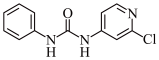
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯苯吡脲晶体中,氮原子的杂化轨道类型为_______ ,羰基碳原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯苯吡脲,其反应方程式为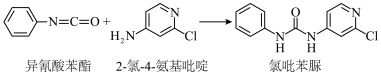
反应过程中,每生成1mol氯苯吡脲,断裂_______ 个σ键,断裂_______ 个π键。
(4)膨大剂能在动物体内代制,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______ 。
②NH3分子的空间结构是_______ ,H2O分子中心原子的杂化类型是_______ 。

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯苯吡脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯苯吡脲,其反应方程式为

反应过程中,每生成1mol氯苯吡脲,断裂
(4)膨大剂能在动物体内代制,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1) 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为________ 。
(2) 的沸点由高到低的顺序为
的沸点由高到低的顺序为________ (填化学式,下同),还原性由强到弱的顺序为________ ,键角由大到小的顺序为________ 。
(3) 是离子化合物,各原子均满足8电子稳定结构,写出
是离子化合物,各原子均满足8电子稳定结构,写出 的电子式:
的电子式:________ 。
(4) 分子中含有
分子中含有 键的数目为
键的数目为________ ,一个 分子中,存在
分子中,存在________ 个 键和
键和________ 个 键。
键。
(1)
 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为(2)
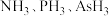 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)
 是离子化合物,各原子均满足8电子稳定结构,写出
是离子化合物,各原子均满足8电子稳定结构,写出 的电子式:
的电子式:(4)
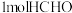 分子中含有
分子中含有 键的数目为
键的数目为 分子中,存在
分子中,存在 键和
键和 键。
键。
您最近一年使用:0次
22-23高三上·广东广州·阶段练习
名校
解题方法
4 . 第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是____ ,配位原子是____ 。
(4)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是_______ , 的空间构型为
的空间构型为_______ 。
(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和_______ 。
②该合金的化学式是_______ 。
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=_______ 。(用含ρ、a的计算式表示)
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是
(4)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是 的空间构型为
的空间构型为(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为
 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和②该合金的化学式是
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=
您最近一年使用:0次
5 . A、B、C、D、E是原子序数依次增大的短周期主族元素,已知基态A、E原子中有两个未成对电子,基态B、C、D原子中均有一个未成对电子。基态A原子中只有两种电子云轮廓不同的能级,且两种能级上的电子总数相等,E的单质能形成一种类似于金刚石结构的共价晶体。
(1)B、C的元素名称分别为_______ 、_______ 。
(2)B和E可组成一种五原子共价化合物,该化合物的电子式为_______ 。
(3)请写出能比较出A和B的非金属性强弱反应的化学方程式:_______ 。
(4)将D的单质加入C的最高价氧化物对应水化物的溶液中,产生的现象是_______ ,写出发生反应的化学方程式:_______ 。
(5)1 mol E的单质晶体中含有_______ molE-E键。
(1)B、C的元素名称分别为
(2)B和E可组成一种五原子共价化合物,该化合物的电子式为
(3)请写出能比较出A和B的非金属性强弱反应的化学方程式:
(4)将D的单质加入C的最高价氧化物对应水化物的溶液中,产生的现象是
(5)1 mol E的单质晶体中含有
您最近一年使用:0次
解题方法
6 . 过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
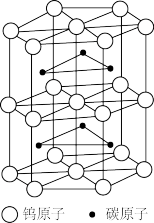
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近一年使用:0次
2022-05-27更新
|
409次组卷
|
5卷引用:河北省秦皇岛市2022届高三三模化学试题
河北省秦皇岛市2022届高三三模化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编河南省2022届高三下学期仿真模拟大联考理科综合化学试题(已下线)新疆博乐高级中学2022届高三第一次诊断性测试理科综合化学试卷广东省部分学校2022届高三下学期高考冲刺化学试题
解题方法
7 . 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。NO 的空间构型是
的空间构型是_______ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为_______ 。
②HCHO分子中C原子轨道的杂化类型为_______ 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。若不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_______ 。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①1mol COCl2分子内含有_______ 个σ键,_______ 个π键。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中断裂的化学键只有配位键,则形成的化学键类型是_______ ,1mol Fe(CO)5中含有_______ mol配位键。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。NO
 的空间构型是
的空间构型是(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为
②HCHO分子中C原子轨道的杂化类型为
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。若不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①1mol COCl2分子内含有
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中断裂的化学键只有配位键,则形成的化学键类型是
您最近一年使用:0次
解题方法
8 . 2020年12月17日,我国嫦娥五号返回器成功携带月壤返回。经专家分析月壤中含有铝、硅、钾、钛、铁、钴等多种元素。回答下列问题:
(1)Al基态原子的价电子排布式是_______ ,钾元素基态原子核外电子的空间运动状态有_______ 种。
(2)在硅酸盐中, 四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。
四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。

图甲为一种无限长单链结构的多硅酸根一部分,其中Si原子的杂化方式为_______ ,该多硅酸根的最简式为_______ 。
(3) 比
比 稳定,原因是
稳定,原因是_______ 。 (铁氰化钾)溶液是检验
(铁氰化钾)溶液是检验 常用的试剂,该物质中
常用的试剂,该物质中 键与
键与 键的个数比为
键的个数比为_______ 。与配体 互为等电子体的化学式为
互为等电子体的化学式为_______ (写一种即可)。
(4)钛、钴的一种化合物晶胞结构如下图所示:

①晶胞中离Ti最近的O有_______ 个;由Ti原子和O原子构成的四面体空隙与二者构成的八面体空隙之比为_______ 。
②已知该晶体的密度为 ,则晶胞中Ti与O的最近距离是
,则晶胞中Ti与O的最近距离是_______ nm(用含 、
、 的代数式表示)。
的代数式表示)。
(1)Al基态原子的价电子排布式是
(2)在硅酸盐中,
 四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。
四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。
图甲为一种无限长单链结构的多硅酸根一部分,其中Si原子的杂化方式为
(3)
 比
比 稳定,原因是
稳定,原因是 (铁氰化钾)溶液是检验
(铁氰化钾)溶液是检验 常用的试剂,该物质中
常用的试剂,该物质中 键与
键与 键的个数比为
键的个数比为 互为等电子体的化学式为
互为等电子体的化学式为(4)钛、钴的一种化合物晶胞结构如下图所示:

①晶胞中离Ti最近的O有
②已知该晶体的密度为
 ,则晶胞中Ti与O的最近距离是
,则晶胞中Ti与O的最近距离是 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
9 . LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe2+基态核外电子排布式为___________ 。
(2)Li、F、P、As四种元素的电负性由小到大的顺序为___________ 。
(3) 的空间构型为
的空间构型为___________ (用文字描述),P的杂化类型是___________ 。
(4)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是___________ 。
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①1mol乙二醇分子中含有σ键的数目为___________ 。
②PF 中P的配位数为
中P的配位数为___________ 。
③相同条件,Li+在___________ (填“LiPF6”或“LiAsF6”)中迁移较快,原因是___________ 。
(6)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。

①氧化物中Fe2+、Fe3+、O2−个数的最简整数比为___________ 。
②已知该晶体的密度为dg·cm−3,设阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe2+基态核外电子排布式为
(2)Li、F、P、As四种元素的电负性由小到大的顺序为
(3)
 的空间构型为
的空间构型为(4)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①1mol乙二醇分子中含有σ键的数目为
②PF
 中P的配位数为
中P的配位数为③相同条件,Li+在
(6)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。

①氧化物中Fe2+、Fe3+、O2−个数的最简整数比为
②已知该晶体的密度为dg·cm−3,设阿伏加德罗常数的值为NA,则晶胞参数a为
您最近一年使用:0次
2022·云南昆明·一模
解题方法
10 . 国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2。回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是___________ ,处于_____ 区,未成对电子数是________ 。
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是___________ , 中心原子采用的杂化类型可能是___________ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。

(3)DMF的结构是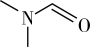 ,σ键与π键的数目比是
,σ键与π键的数目比是___________ ,其中N原子的杂化方式是___________ 。
(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因______ 。
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是___________ cm。
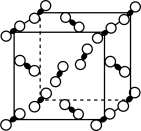
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl
 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

您最近一年使用:0次



