名校
解题方法
1 . 氯苯吡脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
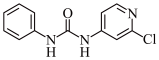
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯苯吡脲晶体中,氮原子的杂化轨道类型为_______ ,羰基碳原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯苯吡脲,其反应方程式为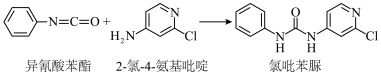
反应过程中,每生成1mol氯苯吡脲,断裂_______ 个σ键,断裂_______ 个π键。
(4)膨大剂能在动物体内代制,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______ 。
②NH3分子的空间结构是_______ ,H2O分子中心原子的杂化类型是_______ 。

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯苯吡脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯苯吡脲,其反应方程式为

反应过程中,每生成1mol氯苯吡脲,断裂
(4)膨大剂能在动物体内代制,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近一年使用:0次
解题方法
2 . 回答下列问题
(1) 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为________ 。
(2)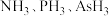 的沸点由高到低的顺序为
的沸点由高到低的顺序为________ (填化学式,下同),还原性由强到弱的顺序为________ ,键角由大到小的顺序为________ 。
(3) 是离子化合物,各原子均满足8电子稳定结构,写出
是离子化合物,各原子均满足8电子稳定结构,写出 的电子式:
的电子式:________ 。
(4)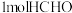 分子中含有
分子中含有 键的数目为
键的数目为________ ,一个 分子中,存在
分子中,存在________ 个 键和
键和________ 个 键。
键。
(1)
 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为(2)
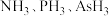 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)
 是离子化合物,各原子均满足8电子稳定结构,写出
是离子化合物,各原子均满足8电子稳定结构,写出 的电子式:
的电子式:(4)
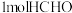 分子中含有
分子中含有 键的数目为
键的数目为 分子中,存在
分子中,存在 键和
键和 键。
键。
您最近一年使用:0次
3 . A、B、C、D、E是原子序数依次增大的短周期主族元素,已知基态A、E原子中有两个未成对电子,基态B、C、D原子中均有一个未成对电子。基态A原子中只有两种电子云轮廓不同的能级,且两种能级上的电子总数相等,E的单质能形成一种类似于金刚石结构的共价晶体。
(1)B、C的元素名称分别为_______ 、_______ 。
(2)B和E可组成一种五原子共价化合物,该化合物的电子式为_______ 。
(3)请写出能比较出A和B的非金属性强弱反应的化学方程式:_______ 。
(4)将D的单质加入C的最高价氧化物对应水化物的溶液中,产生的现象是_______ ,写出发生反应的化学方程式:_______ 。
(5)1 mol E的单质晶体中含有_______ molE-E键。
(1)B、C的元素名称分别为
(2)B和E可组成一种五原子共价化合物,该化合物的电子式为
(3)请写出能比较出A和B的非金属性强弱反应的化学方程式:
(4)将D的单质加入C的最高价氧化物对应水化物的溶液中,产生的现象是
(5)1 mol E的单质晶体中含有
您最近一年使用:0次
解题方法
4 . 很多物质中具有六元环的结构,回答下列问题。
(1)六氯环三磷腈分子中包含一个六元环, 是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50 ℃即可升华。 在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为: 3PCl5+ 3NH4Cl= P3N3Cl6+ 12HCl。

①比较P元素和Cl元素的第一电离能: P_______ _Cl(填“> ”或“<”)。
②在上述反应中断裂的化学键有_______ (填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键 E. 氢键
③P3N3Cl6的晶体类型为_______ 。
(2)1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:

①由A转化为B时,π键数目_______ (填“增加”、 “减少”或“不变”)。
②由B转化为C时,C比B多增加了一种微粒间作用力,该作用力是_______ 。
(3)S和Ge可构成(Ge4S10)4-,Ge和S原子也联结成六边形结构,如图所示。

①基态Ge原子的简化电子排布式为_______ 。
②图中涂黑的微粒代表_______ 元素。
(4)立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,其最小环也是六边形结构。其晶胞结构与金刚石相似,则一个硼原子与相邻氮原子构成的空间构型为_______ 。若氮化硼晶胞边长a pm,则B-N键的键长为_______ pm。

(1)六氯环三磷腈分子中包含一个六元环, 是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50 ℃即可升华。 在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为: 3PCl5+ 3NH4Cl= P3N3Cl6+ 12HCl。

①比较P元素和Cl元素的第一电离能: P
②在上述反应中断裂的化学键有
A.离子键 B.配位键 C.极性键 D.非极性键 E. 氢键
③P3N3Cl6的晶体类型为
(2)1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:

①由A转化为B时,π键数目
②由B转化为C时,C比B多增加了一种微粒间作用力,该作用力是
(3)S和Ge可构成(Ge4S10)4-,Ge和S原子也联结成六边形结构,如图所示。

①基态Ge原子的简化电子排布式为
②图中涂黑的微粒代表
(4)立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,其最小环也是六边形结构。其晶胞结构与金刚石相似,则一个硼原子与相邻氮原子构成的空间构型为

您最近一年使用:0次
名校
解题方法
5 . 目前新合成的砷化镉(Cd3As2)三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为___________ 。Cd原子中第一电离能相对较大的是___________ 原子(填“基态”或“激发态”)。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3___________ PH3(填“>”或“<”),原因是___________ 。
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(4)含砷有机物“对氨基苯砷酸”的结构简式如图,As原子轨道杂化类型为___________ ,1mol对氨基苯砷酸含σ数目为___________ 。

(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___________ 空隙和___________ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___________ 。
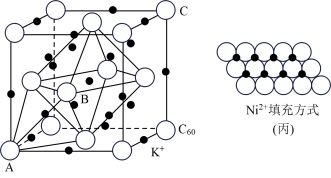
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为anm,每平方米面积上分散的该晶体的质量为___________ g(用a、NA表示)。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯砷酸”的结构简式如图,As原子轨道杂化类型为

(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为anm,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
2021-05-28更新
|
385次组卷
|
2卷引用:河北省石家庄市第二中学2021-2022学年高三上学期九月第四次考试化学试题
6 . I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
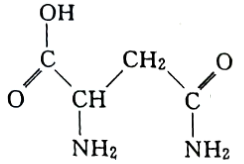
(1)天冬酰胺所含元素中,___________ (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型为___________ 。
(3)写出铬元素基态原子的电子排布式___________ 。
(4)H2S和H2Se的参数对比见下表。
H2S的键角大于H2Se的原因可能为___________ 。
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。
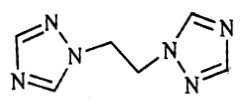
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是___________ 和___________ (填元素符号),配位数为___________ 。
②1molbte分子中含σ键的数目为___________ 。
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3___________ ,CoCl3·4NH3(绿色和紫色)___________ 。

(1)天冬酰胺所含元素中,
(2)天冬酰胺中碳原子的杂化轨道类型为
(3)写出铬元素基态原子的电子排布式
(4)H2S和H2Se的参数对比见下表。
| 化学式 | 键长/nm | 键角 | 沸点/°C |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。

①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是
②1molbte分子中含σ键的数目为
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3
您最近一年使用:0次
解题方法
7 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为___________ ,O、N、C、H四种元素电负性最大的是___________ (填元素符号) 。
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为___________ ,CH2=CHCH2CN分子中σ键与π键的数目比n(σ)∶n(π)=___________ 。
(3)用邻二氮菲(phen,如图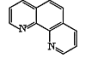 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有___________ (填序号)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因___________ 。
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
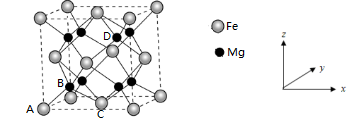
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ),C为(
),C为(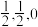 ),则D点坐标参数为
),则D点坐标参数为___________ 。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(3)用邻二氮菲(phen,如图
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ),C为(
),C为(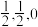 ),则D点坐标参数为
),则D点坐标参数为
您最近一年使用:0次
2021-01-29更新
|
299次组卷
|
2卷引用:河北省衡水市第十四中学2022-2023学年高二下学期第一次选择性考试化学试题
解题方法
8 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,基态时该阳离子的价电子排布图为___ 。
(2)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是___ 。
(3)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___ ;乙醛分子中σ键与π键的个数比为___ 。
(4)古埃及人更早知道合成蓝色颜料,其合成原料中用CaCO3代替了BaCO3。从原料分解的角度判断CaCO3的分解温度比BaCO3更___ (填“高”或“低”)。
(5)如图为SiO2晶胞中Si原子沿y轴方向在xz平面的投影图(即俯视图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于y轴的高度,则SiA与SiB的距离是___ 。
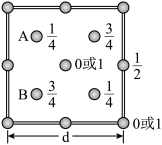
(1)“中国蓝”、“中国紫”中均有Cun+离子,基态时该阳离子的价电子排布图为
(2)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是
(3)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2
 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是(4)古埃及人更早知道合成蓝色颜料,其合成原料中用CaCO3代替了BaCO3。从原料分解的角度判断CaCO3的分解温度比BaCO3更
(5)如图为SiO2晶胞中Si原子沿y轴方向在xz平面的投影图(即俯视图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于y轴的高度,则SiA与SiB的距离是

您最近一年使用:0次
9 . W、X、Y、Z 四种元素原子序数依次减小。已知W的原子序数为29;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能数据如下表;Z原子价电子排布式为nsnnpn。请回答下列问题:
(1)W基态原子的电子排布式为________ 。
(2)电负性:X________ Y(填“>”、“=”或“<”)。
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物高,原因是________ 。
(4)Z2X4中,Z原子采用________ 杂化,每个分子中含有________ 个σ键,________ 个π键。
(5)已知W2+能与氨分子形成配离子[W(NH3)4]2+,该配离子中存在的化学键有________ 。(填标号)
A.金属键 B.离子键 C.共价键 D.配位键
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
(1)W基态原子的电子排布式为
(2)电负性:X
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物高,原因是
(4)Z2X4中,Z原子采用
(5)已知W2+能与氨分子形成配离子[W(NH3)4]2+,该配离子中存在的化学键有
A.金属键 B.离子键 C.共价键 D.配位键
您最近一年使用:0次
名校
10 . 有A、B、C、D、E 五种元素,其中A、B、C 属于同一周期,A 原子最外层p能级的电子数等于次外层的电子数总数;B 原子最外层中有两个不成对的电子;D、E 原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D 与B的质量比为7: 8;E与B的质量比为1: 1。试回答:
(1)写出基态D原子的电子排布式_______________________ 。
(2)用电子式表示AE2的形成过程_______________ ,与AE2 互为等电子体的离子是_______ 。
(3)相同条件下EB2分子和AB2分子两者在水中的溶解度较大的是____ (写分子式),理由是
______________________________ 。
(4)根据VSEPR模型预测C 的氢化物的立体结构为_________ ,B、C 两元素的气态氢化物的稳定性大小关系为:_____________ (填写化学式)。
(5)C的单质中π键的数目为___ ,晶体D 的晶胞中的所含原子数为____________ 。
(1)写出基态D原子的电子排布式
(2)用电子式表示AE2的形成过程
(3)相同条件下EB2分子和AB2分子两者在水中的溶解度较大的是
(4)根据VSEPR模型预测C 的氢化物的立体结构为
(5)C的单质中π键的数目为
您最近一年使用:0次



