名校
解题方法
1 .  及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:
(1)基态铁原子的核外电子排布式为:______ , 比
比 更稳定的原因是:
更稳定的原因是:______ 。
(2) 中铁元素的配位数是
中铁元素的配位数是______ ,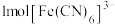 中含有的
中含有的 键的数目为
键的数目为______ , 中C原子的杂化方式为
中C原子的杂化方式为______ 。
(3)铁和氨在 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:______ 。
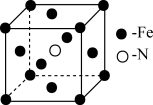
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)______ 。

 及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:(1)基态铁原子的核外电子排布式为:
 比
比 更稳定的原因是:
更稳定的原因是:(2)
 中铁元素的配位数是
中铁元素的配位数是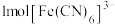 中含有的
中含有的 键的数目为
键的数目为 中C原子的杂化方式为
中C原子的杂化方式为(3)铁和氨在
 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出
 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)
您最近一年使用:0次
名校
2 . 化合物G属于黄酮醋酸类化合物,具有保肝的作用。一种合成化合物G的路线如下:
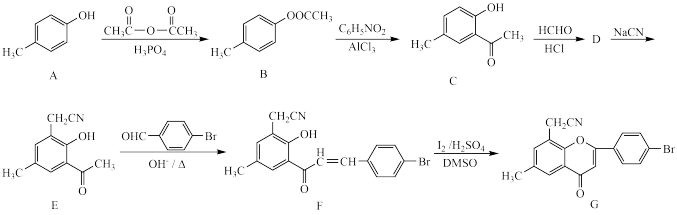
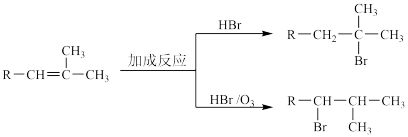
已知:烯烃与HBr发生加成时,不同的条件下有不同的反应方式:
(1)1 mol B分子中含有的σ键数目为_______ 。
(2)E→F分两步进行,反应类型依次为_______ 、_______ 。
(3)D的分子是C10H11O2Cl,D的结构简式为_______ 。
(4)E的一种同分异构体X同时符合下列条件。写出X的结构简式:_______ 。
Ⅰ.能使溴的CCl4溶液褪色,且消耗2 mol Br2
Ⅱ.分子中含3种化学环境不同的氢
(5)设计由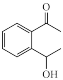 为原料,制备
为原料,制备 的合成路线(无机试剂和有机溶剂任选)
的合成路线(无机试剂和有机溶剂任选) _______ 。

已知:烯烃与HBr发生加成时,不同的条件下有不同的反应方式:

(1)1 mol B分子中含有的σ键数目为
(2)E→F分两步进行,反应类型依次为
(3)D的分子是C10H11O2Cl,D的结构简式为
(4)E的一种同分异构体X同时符合下列条件。写出X的结构简式:
Ⅰ.能使溴的CCl4溶液褪色,且消耗2 mol Br2
Ⅱ.分子中含3种化学环境不同的氢
(5)设计由
 为原料,制备
为原料,制备 的合成路线(无机试剂和有机溶剂任选)
的合成路线(无机试剂和有机溶剂任选)
您最近一年使用:0次
2022-12-17更新
|
736次组卷
|
4卷引用:江苏省南京师范大学附属中学、天一中学、海安中学、海门中学2022-2023学年高三上学期12月联考化学试题
3 . 化合物G是某化工生产中的重要中间体,其合成路线如下:
(注Me: Et:
Et: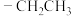 )
)
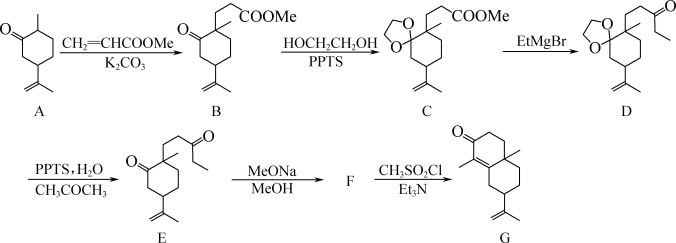
(1)A→B的反应类型为_______ 。
(2)1mol有机物B中所含π键的数目为_______ mol。
(3)E→F的反应类型为加成反应,则F的结构简式为_______ 。
(4)E的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:_______ 。
①能与 溶液发生显色反应;②有四种不同化学环境的氢原子。
溶液发生显色反应;②有四种不同化学环境的氢原子。
(5)已知: ,写出以
,写出以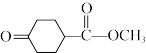 、
、 和
和 为原料制备
为原料制备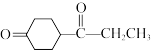 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
(注Me:
 Et:
Et: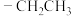 )
)
(1)A→B的反应类型为
(2)1mol有机物B中所含π键的数目为
(3)E→F的反应类型为加成反应,则F的结构简式为
(4)E的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:
①能与
 溶液发生显色反应;②有四种不同化学环境的氢原子。
溶液发生显色反应;②有四种不同化学环境的氢原子。(5)已知:
 ,写出以
,写出以 、
、 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
2022-11-24更新
|
313次组卷
|
2卷引用:江苏省百校联考2022-2023学年高二下学期5月第一次考试化学试题
名校
4 . 化合物G是某化工生产中的重要中间体,其合成路线如下:
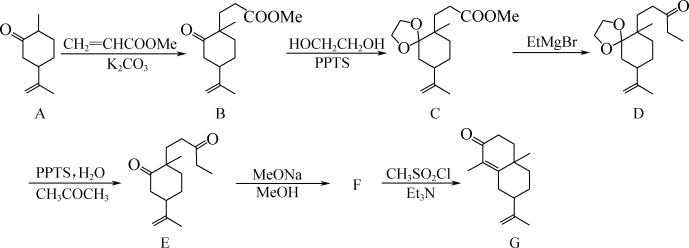
Me: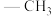 Et:
Et: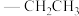
(1)1mol有机物B中所含π键的数目为_______ mol。
(2)D中含有_______ 个手性碳原子。
(3)E→F的反应类型为加成反应,则F的结构简式为_______ 。
(4)C的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:_______ 。
①能与 溶液发生显色反应。
溶液发生显色反应。
②有四种不同化学环境的氢原子。
(5)已知: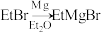 。写出以
。写出以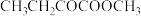 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

Me:
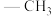 Et:
Et: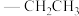
(1)1mol有机物B中所含π键的数目为
(2)D中含有
(3)E→F的反应类型为加成反应,则F的结构简式为
(4)C的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:
①能与
 溶液发生显色反应。
溶液发生显色反应。②有四种不同化学环境的氢原子。
(5)已知:
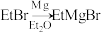 。写出以
。写出以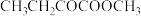 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
名校
5 . 原子序数小于36的 、
、 、
、 、
、 、
、 五种元素,原子序数依次增大。五种元素中,仅
五种元素,原子序数依次增大。五种元素中,仅 为金属元素,其原子序数为26。
为金属元素,其原子序数为26。 价电子排布式为
价电子排布式为 ,元素
,元素 基态原子
基态原子 电子总数与
电子总数与 电子总数相等,
电子总数相等, 与其它四种元素能层数不同,且未成对电子数目为1个。
与其它四种元素能层数不同,且未成对电子数目为1个。
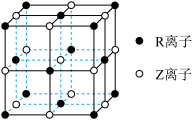
(1)某晶体的晶胞结构如图所示,则该化合物的化学式为_______ ( 、
、 用具体元素符号表示)。该晶体中
用具体元素符号表示)。该晶体中 离子的基态核外电子排布式为
离子的基态核外电子排布式为_______ 。
(2) 配合物
配合物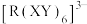 中含有
中含有 键的数目为
键的数目为_______ 。
(3)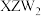 是一种高毒类物质,结构与甲醛
是一种高毒类物质,结构与甲醛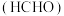 相似,其沸点高于甲醛的主要原因是
相似,其沸点高于甲醛的主要原因是_______ 。
(4) 为黄色、油状、具有刺激性气味的液体,该分子的立体构型为
为黄色、油状、具有刺激性气味的液体,该分子的立体构型为_______ (用文字描述)。
(5)物质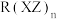 ,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断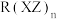 晶体属于
晶体属于_______ (填晶体类型)。若配合物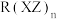 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则
_______ 。
 、
、 、
、 、
、 、
、 五种元素,原子序数依次增大。五种元素中,仅
五种元素,原子序数依次增大。五种元素中,仅 为金属元素,其原子序数为26。
为金属元素,其原子序数为26。 价电子排布式为
价电子排布式为 ,元素
,元素 基态原子
基态原子 电子总数与
电子总数与 电子总数相等,
电子总数相等, 与其它四种元素能层数不同,且未成对电子数目为1个。
与其它四种元素能层数不同,且未成对电子数目为1个。(1)某晶体的晶胞结构如图所示,则该化合物的化学式为
 、
、 用具体元素符号表示)。该晶体中
用具体元素符号表示)。该晶体中 离子的基态核外电子排布式为
离子的基态核外电子排布式为
(2)
 配合物
配合物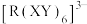 中含有
中含有 键的数目为
键的数目为(3)
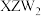 是一种高毒类物质,结构与甲醛
是一种高毒类物质,结构与甲醛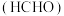 相似,其沸点高于甲醛的主要原因是
相似,其沸点高于甲醛的主要原因是(4)
 为黄色、油状、具有刺激性气味的液体,该分子的立体构型为
为黄色、油状、具有刺激性气味的液体,该分子的立体构型为(5)物质
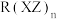 ,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断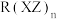 晶体属于
晶体属于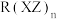 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E、F的核电荷数依次增大。A的最外层电子数是次外层电子数的一半、是最内层电子数的2倍,D和E的价电子数都是7,F的基态原子中有4个未成对电子。
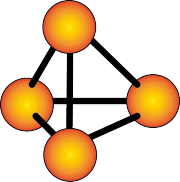
(1)A在元素周期表中的位置是_______ ,基态 的核外电子排布式是
的核外电子排布式是_______ 。
(2)A、B、C、D的第一电离能由小到大的顺序是_______ (用元素符号表示)。
(3) 分子的空间结构为
分子的空间结构为_______ 。
(4)单质 的结构如图所示,
的结构如图所示, 该分子中含有的
该分子中含有的 键的数目为
键的数目为_______ 。

(1)A在元素周期表中的位置是
 的核外电子排布式是
的核外电子排布式是(2)A、B、C、D的第一电离能由小到大的顺序是
(3)
 分子的空间结构为
分子的空间结构为(4)单质
 的结构如图所示,
的结构如图所示, 该分子中含有的
该分子中含有的 键的数目为
键的数目为
您最近一年使用:0次
解题方法
7 . 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子排布式为________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____________ 。
②1 mol [Ni(NH3)6]2+含有σ键为___ mol。
③氨的沸点高于膦(PH3),原因是________ 。
(3)某镍白铜合金的立方晶胞结构如图所示,该合金的化学式为________ 。

(1)镍元素基态原子的价电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②1 mol [Ni(NH3)6]2+含有σ键为
③氨的沸点高于膦(PH3),原因是
(3)某镍白铜合金的立方晶胞结构如图所示,该合金的化学式为

您最近一年使用:0次
解题方法
8 . X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。

(1)EDTA中碳原子杂化轨道类型为______ ;EDTA中四种元素的电负性由小到大的顺序为________ 。
(2)Fe3+基态外围电子排布式为______ 。
(3)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6 ℃)比正二十一烷的沸点(100 ℃)高的原因是______ 。
(4)1 mol 碳酸分子中含有σ键的数目为______ 。
(5)X中的配位原子是______ 。

(1)EDTA中碳原子杂化轨道类型为
(2)Fe3+基态外围电子排布式为
(3)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6 ℃)比正二十一烷的沸点(100 ℃)高的原因是
(4)1 mol 碳酸分子中含有σ键的数目为
(5)X中的配位原子是
您最近一年使用:0次
解题方法
9 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为_________ ;
(2)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体_________ 。

(3)C、N、O元素的第一电离能由大到小的顺序为_______ 。
(4)乙醇的沸点高于丙酮,这是因为_________ 。
(5)与NH 互为等电子体的一种分子为
互为等电子体的一种分子为____ (填化学式)。
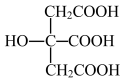
(6)柠檬酸的结构简式见下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_____ mol。
(1)Fe基态核外电子排布式为
(2)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体

(3)C、N、O元素的第一电离能由大到小的顺序为
(4)乙醇的沸点高于丙酮,这是因为
(5)与NH
 互为等电子体的一种分子为
互为等电子体的一种分子为(6)柠檬酸的结构简式见下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为

您最近一年使用:0次
名校
解题方法
10 . 氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式___ ;基态铬、氮原子的核外未成对电子数之比为___ 。
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为___ ,过硫酸铵的阳离子的空间构型为___ 。
(3) 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的, 中孤电子对与π键比值为
中孤电子对与π键比值为__ ,CP的中心Co3+的配位数为___ 。
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为
(3)
 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的, 中孤电子对与π键比值为
中孤电子对与π键比值为
您最近一年使用:0次



