解题方法
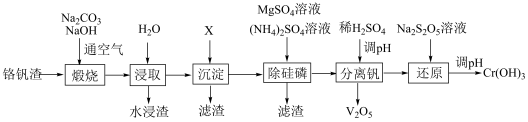
1 . 铬和钒具有广泛用途,铬钒中铬和钒以低价态含氧酸盐形式存在,主要杂质为氧化铁及铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如图所示: 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在。
形式存在。
②氧化性: 。
。
请回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为______ ,基态V原子的未成对电子数为______ 。
(2)“煅烧”后,若铬被氧化为相应的最高价含氧酸盐,则 元素以化合物
元素以化合物______ (填化学式,下同)的形式存在;水浸渣的主要成分为 和
和______ ,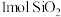 中含有的
中含有的 键数目为
键数目为______ 。
(3)“沉淀”步骤得到的滤渣为 ,X可选择______(填标号)。
,X可选择______(填标号)。
(4)“还原”步骤中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为__________________ 。
 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在。
形式存在。②氧化性:
 。
。请回答下列问题:
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)“煅烧”后,若铬被氧化为相应的最高价含氧酸盐,则
 元素以化合物
元素以化合物 和
和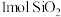 中含有的
中含有的 键数目为
键数目为(3)“沉淀”步骤得到的滤渣为
 ,X可选择______(填标号)。
,X可选择______(填标号)。A. 溶液 溶液 | B.氨水 | C.硫酸溶液 | D.盐酸 |
(4)“还原”步骤中加入
 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 二氯化一氯五氨合钴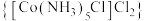 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。
Ⅰ.制备
某实验小组利用以下装置和流程制备 。
。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
步骤ⅲ,待溶液中停止产生气泡后,缓慢加入 浓盐酸,在
浓盐酸,在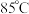 水浴中加热
水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。
Ⅱ.产品结构分析
(2) 中存在的化学键有
中存在的化学键有_______ (填标号);
A.离子键 B.范德华力 C.极性共价键 D.非极性共价键 E.配位键 F.氢键
(3) 中含
中含 键的数目为
键的数目为_______ 。
Ⅲ.实验探究
(4)实验小组在制备过程中发现 溶液中直接加入
溶液中直接加入 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证
的氧化产生了影响,提出以下猜想并设计实验验证
猜想1:加入氯化铵溶液,增强了 的氧化性
的氧化性
猜想2:加入浓氨水形成配合物,增强了 离子的还原性
离子的还原性
实验结论:猜想1不合理,猜想2合理。
①a是_______ ,b是_______ ;
②步骤ⅰ中氯化铵的作用是_______ 。
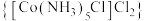 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。Ⅰ.制备

某实验小组利用以下装置和流程制备
 。
。
 ,发生反应的离子方程式为
,发生反应的离子方程式为步骤ⅲ,待溶液中停止产生气泡后,缓慢加入
 浓盐酸,在
浓盐酸,在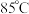 水浴中加热
水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。Ⅱ.产品结构分析
(2)
 中存在的化学键有
中存在的化学键有A.离子键 B.范德华力 C.极性共价键 D.非极性共价键 E.配位键 F.氢键
(3)
 中含
中含 键的数目为
键的数目为Ⅲ.实验探究
(4)实验小组在制备过程中发现
 溶液中直接加入
溶液中直接加入 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证
的氧化产生了影响,提出以下猜想并设计实验验证猜想1:加入氯化铵溶液,增强了
 的氧化性
的氧化性猜想2:加入浓氨水形成配合物,增强了
 离子的还原性
离子的还原性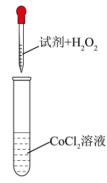
| 实验编号 | 试剂 | 现象 |
| 1 | 0.5mL水 | 无明显变化 |
| 2 | a | 无明显变化 |
| 3 | b | 溶液变为深红色,且出现棕褐色沉淀 |
①a是
②步骤ⅰ中氯化铵的作用是
您最近一年使用:0次
名校
解题方法
3 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,原子序数逐渐增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子,回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的电负性由大到小的顺序是___________ 。
(2)1mol QWX与1mol 所含
所含 键的比值为
键的比值为___________ 。
(3)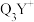 中心原子采用
中心原子采用___________ 杂化,其键角比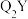 中键角
中键角___________ (填“大”或“小”),原因是:___________ 。
(4)根据VSEPR理论预测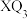 的空间构型为
的空间构型为___________ 。
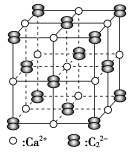
(5)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为___________ 。
①该化合物的化学式为:___________ 。
②预测该化合物熔点应___________ 金刚石(填“高于”或“低于”),原因是:___________ 。
(1)X、Y、Z三种元素的电负性由大到小的顺序是
(2)1mol QWX与1mol
 所含
所含 键的比值为
键的比值为(3)
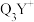 中心原子采用
中心原子采用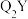 中键角
中键角(4)根据VSEPR理论预测
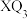 的空间构型为
的空间构型为(5)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为
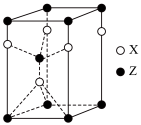
①该化合物的化学式为:
②预测该化合物熔点应
您最近一年使用:0次
名校
解题方法
4 . 我国科学家利用锰簇催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇的可逆结构异构化反应如图:
(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为_______ 形。
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是_______ (填“Mn”或“Cr”),理由是_______ 。
(3)在上述异构化反应中,1molA中由Mn形成的σ键有_______ mol。
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:_______ ,距离Mn原子最近的Mn原子有_______ 个。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为_______ 。
③已知:MnS晶体的密度为ρg·cm3, 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为_______ pm(列出计算式即可)。

(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是
(3)在上述异构化反应中,1molA中由Mn形成的σ键有
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:

②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为
③已知:MnS晶体的密度为ρg·cm3,
 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
您最近一年使用:0次
名校
5 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:_______ ,B:_______ ,E_______ ,G:_______ 。
(2)C、D、E三种元素的原子半径由大到小的顺序为_______ (用元素符号表示)。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:_______ ,_______ ,_______ 。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为_______ 。
(5)G元素可形成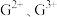 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:_______ 。
(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是_______ 化合物(填“离子”或“共价”)。根据“对角线规则”,元素周期表中某些处于对角的元素,它们的化合物性质具有相似性,则M的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: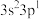 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)C、D、E三种元素的原子半径由大到小的顺序为
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)G元素可形成
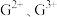 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
解题方法
6 . 三草酸合铁酸钾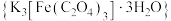 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: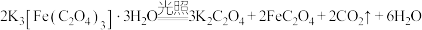 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
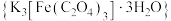 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: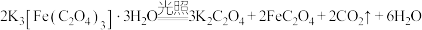 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为
您最近一年使用:0次
解题方法
7 . 乙炔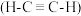 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
碳化钙晶胞示意图: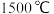 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。
①反应的化学方程式为_______ 。
②上述反应中碳原子轨道杂化类型的变化为_______ 。
③乙炔分子中 键和
键和 键数目之比为
键数目之比为_______ 。
(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
① 基态核外电子排布式为
基态核外电子排布式为_______ 。
②碳化钙晶体中哑铃形 的存在,使晶胞延一个方向拉长。碳化钙晶体中1个
的存在,使晶胞延一个方向拉长。碳化钙晶体中1个 周围距离
周围距离最近 的 围成的几何图形为
围成的几何图形为_______ (填正方形、正四面体或正八面体)。
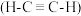 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。碳化钙晶胞示意图:
 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。①反应的化学方程式为
②上述反应中碳原子轨道杂化类型的变化为
③乙炔分子中
 键和
键和 键数目之比为
键数目之比为(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
①
 基态核外电子排布式为
基态核外电子排布式为②碳化钙晶体中哑铃形
 的存在,使晶胞延一个方向拉长。碳化钙晶体中1个
的存在,使晶胞延一个方向拉长。碳化钙晶体中1个 周围距离
周围距离 围成的几何图形为
围成的几何图形为
您最近一年使用:0次
8 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________  键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有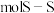 键。
键。
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
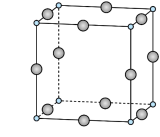
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
9 . 依据物质结构知识回答下列问题。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为___________ 。
(2)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为___________ ,其中Se原子采用的轨道杂化方式为___________ 。
(3)已知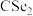 与
与 结构相似,①
结构相似,①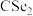 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为___________ (填序号)。
Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为___________ 。氨基氰( )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳( ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为___________ 。
(5)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是___________。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
(2)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为(3)已知
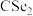 与
与 结构相似,①
结构相似,①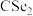 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)已知
 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为 )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳( ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为(5)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是___________。
A. | B. |
C.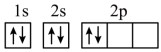 | D.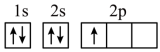 |
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为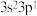 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次



