名校
解题方法
1 . 元素及其化合物的性质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有_______ mol。
(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式_______ 。
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是_______ (写出名称)。
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为_______ (填序号)。
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是_______ (填“极性”或“非极性”)分子。
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。
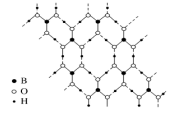
则1molH3BO3形成的晶体中有_______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,其中B原子的杂化方式是_______ 。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是
 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/(kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。

则1molH3BO3形成的晶体中有
您最近一年使用:0次
名校
2 . 联合国将2019年定为“国际化学元素周期表年”。元素周期表前四周期的元素a、b、c、d、e、f的原子序数依次增大。a、b、d的价电子层中未成对电子均只有1个,a的基态原子核外有3种不同能量的电子,b、d的单质均能与水剧烈反应,b-和d+核外电子数相差8,c的最外层电子数为其电子层数的2倍,补充维生素D可促进人体对元素e的吸收,f的价电子层中的未成对电子数为4.回答下列问题:
(1)a、b、c的电负性由小到大的顺序为___________ (用元素符号表示)。基态f原子的核外电子排布式为___________ 。
(2)ab3分子中心原子的杂化方式为___________ ,其键角为___________ 。
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为___________ (用化学式表示),理由:___________ 。
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为___________ ,提供孤电子对的原子是___________ (填元素符号),CO分子中σ键与π键数目之比为___________ 。
(1)a、b、c的电负性由小到大的顺序为
(2)ab3分子中心原子的杂化方式为
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为
您最近一年使用:0次
解题方法
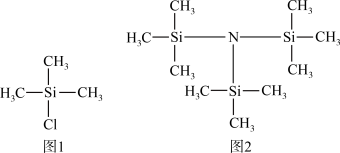
3 . 科学家最近开发了催化剂Mo3S4Fe捕获N2、Na和三甲基硅酰氯[Cl-Si(CH3)3] (用M代表,结构简式如图1)合成[(CH3)3Si]3N (用G代表,结构简式如图2)。
回答下列问题:
(1)基态Mo原子的价层电子排布式为4d55s1,其位于元素周期表_______ 区,最高化合价为_______ 。
(2)1 mol G中采用sp3杂化的原子有_______ mol。已知SiH4中Si—H键的电子云偏向H,G中元素电负性由小到大的顺序为_______ (填元素符号)。在G中Si、N原子构成的立体结构为_______ 。
(3)我国科学家成功研制出超灵敏传感器(MoS2/In2O3)检测气体—NO2。 晶体层状结构如图3所示。
晶体层状结构如图3所示。
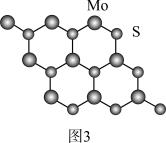
在该结构中Mo原子数、共价键数之比为_______ 。
(4)铵铁蓝广泛用于生产生活中。制备原理如下:
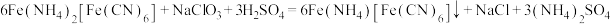
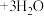
①Fe(NH4)2[Fe(CN)6]中外界的Fe2+比内界的易被氧化,其原因是_______ 。
②1 mol [Fe(CN)6]4-含_______ mol σ键。
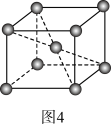
(5)钼晶胞如图4所示。已知两个钼原子最近距离为a cm,设NA为阿伏加德罗常数的值,钼晶体密度为ρ g/cm3。则钼的摩尔质量为_______ g/mol。

回答下列问题:
(1)基态Mo原子的价层电子排布式为4d55s1,其位于元素周期表
(2)1 mol G中采用sp3杂化的原子有
(3)我国科学家成功研制出超灵敏传感器(MoS2/In2O3)检测气体—NO2。
 晶体层状结构如图3所示。
晶体层状结构如图3所示。
在该结构中Mo原子数、共价键数之比为
(4)铵铁蓝广泛用于生产生活中。制备原理如下:
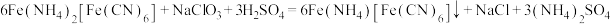
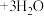
①Fe(NH4)2[Fe(CN)6]中外界的Fe2+比内界的易被氧化,其原因是
②1 mol [Fe(CN)6]4-含
(5)钼晶胞如图4所示。已知两个钼原子最近距离为a cm,设NA为阿伏加德罗常数的值,钼晶体密度为ρ g/cm3。则钼的摩尔质量为

您最近一年使用:0次
2022-12-23更新
|
241次组卷
|
3卷引用:河南省郑州市等3地2022-2023学年高三上学期12月月考化学试题
河南省郑州市等3地2022-2023学年高三上学期12月月考化学试题 河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)
名校
4 . 化合物G属于黄酮醋酸类化合物,具有保肝的作用。一种合成化合物G的路线如下:
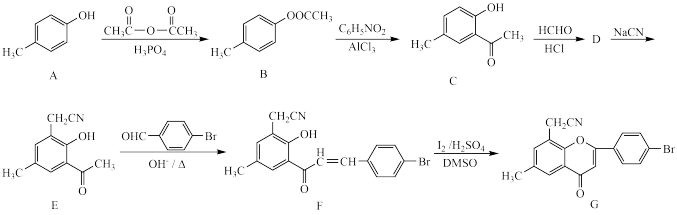
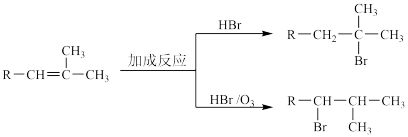
已知:烯烃与HBr发生加成时,不同的条件下有不同的反应方式:
(1)1 mol B分子中含有的σ键数目为_______ 。
(2)E→F分两步进行,反应类型依次为_______ 、_______ 。
(3)D的分子是C10H11O2Cl,D的结构简式为_______ 。
(4)E的一种同分异构体X同时符合下列条件。写出X的结构简式:_______ 。
Ⅰ.能使溴的CCl4溶液褪色,且消耗2 mol Br2
Ⅱ.分子中含3种化学环境不同的氢
(5)设计由 为原料,制备
为原料,制备 的合成路线(无机试剂和有机溶剂任选)
的合成路线(无机试剂和有机溶剂任选) _______ 。

已知:烯烃与HBr发生加成时,不同的条件下有不同的反应方式:

(1)1 mol B分子中含有的σ键数目为
(2)E→F分两步进行,反应类型依次为
(3)D的分子是C10H11O2Cl,D的结构简式为
(4)E的一种同分异构体X同时符合下列条件。写出X的结构简式:
Ⅰ.能使溴的CCl4溶液褪色,且消耗2 mol Br2
Ⅱ.分子中含3种化学环境不同的氢
(5)设计由
 为原料,制备
为原料,制备 的合成路线(无机试剂和有机溶剂任选)
的合成路线(无机试剂和有机溶剂任选)
您最近一年使用:0次
2022-12-17更新
|
736次组卷
|
4卷引用:江苏省南京师范大学附属中学、天一中学、海安中学、海门中学2022-2023学年高三上学期12月联考化学试题
5 . 镍氢电池有着广泛的应用,旧电池的回收和再利用同样的重要。废旧镍氢电池中常含有NiOOH、 、及少量
、及少量 、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
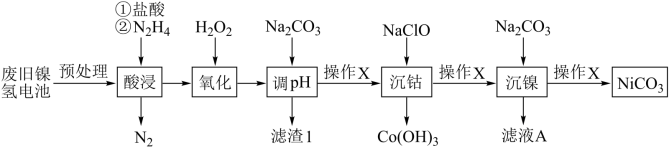
(1)“酸浸”中,加入 的主要作用是
的主要作用是_______ 。
(2)“氧化”过程中与 有关的离子方程式是
有关的离子方程式是_______ 。滤渣1主要成分是弱碱,其化学式是_______ 。
(3)滤液A的主要溶质是_______ ;操作X是_______ 。
(4)丁二酮肟(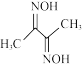 )是检验
)是检验 的灵敏试剂,在稀氨水介质中,
的灵敏试剂,在稀氨水介质中, 与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
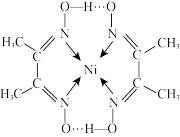
回答下列问题:
①基态Ni中最外层电子所占据的原子轨道有_______ 种伸展方向。
② 丁二酮肟分子含有
丁二酮肟分子含有 键数目为
键数目为_______ ( 是阿伏加德罗常数的值)
是阿伏加德罗常数的值)
③丁二酮肟镍分子内不存在的作用力有_______ (填序号)
A.金属键 B.氢键 C. 键 D.配位键
键 D.配位键
 、及少量
、及少量 、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
(1)“酸浸”中,加入
 的主要作用是
的主要作用是(2)“氧化”过程中与
 有关的离子方程式是
有关的离子方程式是(3)滤液A的主要溶质是
(4)丁二酮肟(
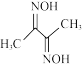 )是检验
)是检验 的灵敏试剂,在稀氨水介质中,
的灵敏试剂,在稀氨水介质中, 与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
回答下列问题:
①基态Ni中最外层电子所占据的原子轨道有
②
 丁二酮肟分子含有
丁二酮肟分子含有 键数目为
键数目为 是阿伏加德罗常数的值)
是阿伏加德罗常数的值)③丁二酮肟镍分子内不存在的作用力有
A.金属键 B.氢键 C.
 键 D.配位键
键 D.配位键
您最近一年使用:0次
6 . 化合物G是某化工生产中的重要中间体,其合成路线如下:
(注Me: Et:
Et: )
)
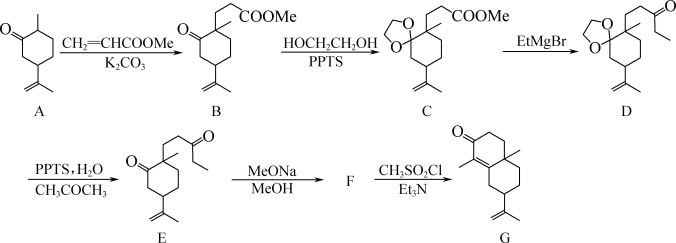
(1)A→B的反应类型为_______ 。
(2)1mol有机物B中所含π键的数目为_______ mol。
(3)E→F的反应类型为加成反应,则F的结构简式为_______ 。
(4)E的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:_______ 。
①能与 溶液发生显色反应;②有四种不同化学环境的氢原子。
溶液发生显色反应;②有四种不同化学环境的氢原子。
(5)已知: ,写出以
,写出以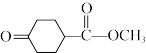 、
、 和
和 为原料制备
为原料制备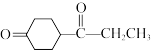 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
(注Me:
 Et:
Et: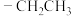 )
)
(1)A→B的反应类型为
(2)1mol有机物B中所含π键的数目为
(3)E→F的反应类型为加成反应,则F的结构简式为
(4)E的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:
①能与
 溶液发生显色反应;②有四种不同化学环境的氢原子。
溶液发生显色反应;②有四种不同化学环境的氢原子。(5)已知:
 ,写出以
,写出以 、
、 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
2022-11-24更新
|
313次组卷
|
2卷引用:江苏省百校联考2022-2023学年高二下学期5月第一次考试化学试题
名校
解题方法
7 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。

(1)碳族元素位于周期表__________ 区,基态锗原子外围电子的轨道表示式为__________ 。
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 、
、 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是____________ 。
(3)金刚石(甲)、石墨(乙)、 (丙)的结构如图所示:
(丙)的结构如图所示:

①12g金刚石和石墨中含有的 键数目之比为
键数目之比为__________ 。
②金刚石的熔点高于 ,但低于石墨,原因是
,但低于石墨,原因是__________ 。
③ 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是__________ 。
A. B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为_________ ,其结构与石墨相似却不导电,原因是_____________ ,阿伏加德罗常数
__________ 。(用含a、k、ρ的式子表示)。


(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 、
、 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是(3)金刚石(甲)、石墨(乙)、
 (丙)的结构如图所示:
(丙)的结构如图所示:
①12g金刚石和石墨中含有的
 键数目之比为
键数目之比为②金刚石的熔点高于
 ,但低于石墨,原因是
,但低于石墨,原因是③
 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是A.
 B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内
 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为

您最近一年使用:0次
8 . 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)基态Cu原子的价电子排布式为_______ ;在周期表中,Cu元素属于_______ 区。
(2)往硫酸铜溶液中加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,写出沉淀溶解的离子方程式:_______ 。
(3)1mol[Cu(H2O)4]2+中含有σ键的数目为_______ 。
(4)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______ ,其结构可用示意图表示为_______ 。
(1)基态Cu原子的价电子排布式为
(2)往硫酸铜溶液中加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,写出沉淀溶解的离子方程式:
(3)1mol[Cu(H2O)4]2+中含有σ键的数目为
(4)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
您最近一年使用:0次
名校
解题方法
9 . 第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是____ ,配位原子是____ 。
(4)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是_______ , 的空间构型为
的空间构型为_______ 。
(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和_______ 。
②该合金的化学式是_______ 。
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=_______ 。(用含ρ、a的计算式表示)
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是
(4)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是 的空间构型为
的空间构型为(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为
 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和②该合金的化学式是
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=
您最近一年使用:0次
10 . 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的核外电子排布式为_______ ,其中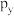 原子轨道上的电子数为
原子轨道上的电子数为_______ 个。
(2) 的配合物有多种。在
的配合物有多种。在 和
和 三种微粒的配体中,所含原子电负性由大到小的排序为
三种微粒的配体中,所含原子电负性由大到小的排序为_______ ; 含有
含有_______ 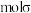 键;
键;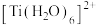 的配体中提供孤电子对的原子是
的配体中提供孤电子对的原子是_______ ; 中
中 的化合价是
的化合价是_______ ; 的球棍结构如图,
的球棍结构如图, 的配位数是
的配位数是_______ 。

(1)基态钛原子的核外电子排布式为
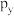 原子轨道上的电子数为
原子轨道上的电子数为(2)
 的配合物有多种。在
的配合物有多种。在 和
和 三种微粒的配体中,所含原子电负性由大到小的排序为
三种微粒的配体中,所含原子电负性由大到小的排序为 含有
含有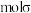 键;
键;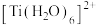 的配体中提供孤电子对的原子是
的配体中提供孤电子对的原子是 中
中 的化合价是
的化合价是 的球棍结构如图,
的球棍结构如图, 的配位数是
的配位数是
您最近一年使用:0次



