解题方法
1 . 某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+ Zn+(1+
Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ ZnSO4[Zn(OH)2]3∙xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3∙xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。

(1)Mn2+的核外电子排布式为___________ ;有机高聚物中C的杂化方式为___________ 。
(2)已知CN—与N2互为等电子体,推算拟卤(CN)2分子中σ键与π键数目之比为___________ 。
(3) 的空间构型为
的空间构型为___________ 。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

①Mn的第一电离能是__ (数值用上图中字母表示,下同),O2的键能是__ ,MnO的晶格能是___________ 。
②Mn2+比Fe2+稳定,其原因是___________ 。
(5)R由Zn、S组成(S原子位于晶胞的面心和顶点),其化学式为___________ (用元素符号表示)。已知其晶胞边长为acm,则该晶胞的密度为___________ g·cm3(阿伏加德罗常数用NA表示)。

 Zn+(1+
Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ ZnSO4[Zn(OH)2]3∙xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3∙xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
(1)Mn2+的核外电子排布式为
(2)已知CN—与N2互为等电子体,推算拟卤(CN)2分子中σ键与π键数目之比为
(3)
 的空间构型为
的空间构型为(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

①Mn的第一电离能是
②Mn2+比Fe2+稳定,其原因是
(5)R由Zn、S组成(S原子位于晶胞的面心和顶点),其化学式为

您最近一年使用:0次
名校
2 . 原子序数小于36的 、
、 、
、 、
、 、
、 五种元素,原子序数依次增大。五种元素中,仅
五种元素,原子序数依次增大。五种元素中,仅 为金属元素,其原子序数为26。
为金属元素,其原子序数为26。 价电子排布式为
价电子排布式为 ,元素
,元素 基态原子
基态原子 电子总数与
电子总数与 电子总数相等,
电子总数相等, 与其它四种元素能层数不同,且未成对电子数目为1个。
与其它四种元素能层数不同,且未成对电子数目为1个。
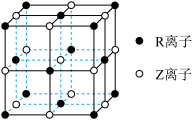
(1)某晶体的晶胞结构如图所示,则该化合物的化学式为_______ ( 、
、 用具体元素符号表示)。该晶体中
用具体元素符号表示)。该晶体中 离子的基态核外电子排布式为
离子的基态核外电子排布式为_______ 。
(2) 配合物
配合物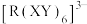 中含有
中含有 键的数目为
键的数目为_______ 。
(3)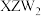 是一种高毒类物质,结构与甲醛
是一种高毒类物质,结构与甲醛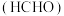 相似,其沸点高于甲醛的主要原因是
相似,其沸点高于甲醛的主要原因是_______ 。
(4) 为黄色、油状、具有刺激性气味的液体,该分子的立体构型为
为黄色、油状、具有刺激性气味的液体,该分子的立体构型为_______ (用文字描述)。
(5)物质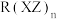 ,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断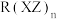 晶体属于
晶体属于_______ (填晶体类型)。若配合物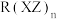 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则
_______ 。
 、
、 、
、 、
、 、
、 五种元素,原子序数依次增大。五种元素中,仅
五种元素,原子序数依次增大。五种元素中,仅 为金属元素,其原子序数为26。
为金属元素,其原子序数为26。 价电子排布式为
价电子排布式为 ,元素
,元素 基态原子
基态原子 电子总数与
电子总数与 电子总数相等,
电子总数相等, 与其它四种元素能层数不同,且未成对电子数目为1个。
与其它四种元素能层数不同,且未成对电子数目为1个。(1)某晶体的晶胞结构如图所示,则该化合物的化学式为
 、
、 用具体元素符号表示)。该晶体中
用具体元素符号表示)。该晶体中 离子的基态核外电子排布式为
离子的基态核外电子排布式为
(2)
 配合物
配合物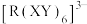 中含有
中含有 键的数目为
键的数目为(3)
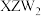 是一种高毒类物质,结构与甲醛
是一种高毒类物质,结构与甲醛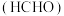 相似,其沸点高于甲醛的主要原因是
相似,其沸点高于甲醛的主要原因是(4)
 为黄色、油状、具有刺激性气味的液体,该分子的立体构型为
为黄色、油状、具有刺激性气味的液体,该分子的立体构型为(5)物质
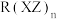 ,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断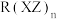 晶体属于
晶体属于 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则
您最近一年使用:0次
名校
3 . 回答下列问题

(1)NH3分子中氮原子的轨道杂化类型是___________ ;C、N、O元素的第一电离能由大到小的顺序为___________ 。与NH 互为等电子体的一种分子为
互为等电子体的一种分子为___________ (填化学式)。
(2)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为___________ 。
(3)Cu2O晶体结构与CsCl相似,只是用Cu4O占据CsCl晶体(图I)中的Cl的位置,而Cs所占位置由O原子占据,如图II所示,
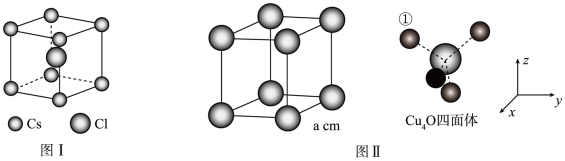
若Cu2O的晶胞参数为acm,设NA为阿伏加德罗常数的值,则其密度表达式为:___________ g/cm3

(1)NH3分子中氮原子的轨道杂化类型是
 互为等电子体的一种分子为
互为等电子体的一种分子为(2)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
(3)Cu2O晶体结构与CsCl相似,只是用Cu4O占据CsCl晶体(图I)中的Cl的位置,而Cs所占位置由O原子占据,如图II所示,

若Cu2O的晶胞参数为acm,设NA为阿伏加德罗常数的值,则其密度表达式为:
您最近一年使用:0次
4 . 中科院大连化物所的科学家在乙酰酮修饰锰氧化物L酸催化胺选择氧化方面的研究取得新进展。回答下列问题:
(1)Mn元素的价层电子排布式为_______ ;Mn元素的一种配合物K3[Mn(CN)6]具有反磁性,配体CN-的电子式为_______ 。
(2)乙腈(CH3CN)分子中碳原子的杂化类型有_______ ,该分子中σ键和π键的个数比为_______ 。
(3)苯胺(C6H5NH2)的晶体类型是_______ ,苯胺与甲苯的相对分子质量相近,但苯胺的熔、沸点分别高于甲苯的熔、沸点,原因是_______ 。
(4)锰的某种氧化物的晶胞结构如图所示:

该锰元素的氧化物化学式为_______ ,晶体的密度为_______  (用含a、b和NA的代数式表示,NA为阿伏加德罗常数的值)。
(用含a、b和NA的代数式表示,NA为阿伏加德罗常数的值)。
(1)Mn元素的价层电子排布式为
(2)乙腈(CH3CN)分子中碳原子的杂化类型有
(3)苯胺(C6H5NH2)的晶体类型是
(4)锰的某种氧化物的晶胞结构如图所示:

该锰元素的氧化物化学式为
 (用含a、b和NA的代数式表示,NA为阿伏加德罗常数的值)。
(用含a、b和NA的代数式表示,NA为阿伏加德罗常数的值)。
您最近一年使用:0次
2021-09-05更新
|
132次组卷
|
3卷引用:甘肃省高台县第一中学2021-2022学年高三上学期第二次检测化学试题
解题方法
5 . 锌及其化合物在工农业生产及科学研究中具有广泛的用途。回答下列问题:
(1)Zn位于元素周期表的___________ 区,基态Zn2+的核外电子排布式为___________ 。
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。
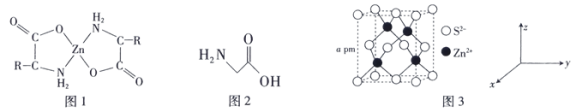
①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中 的坐标有
的坐标有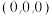 、
、 ,与
,与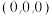 距离最近的
距离最近的 还有
还有___________ (填坐标)。
②Zn2+占据___________ (填“八面体”或“四面体”)空隙,空隙利用率为___________ %。
③ZnS的密度为___________  。
。
(1)Zn位于元素周期表的
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中
 的坐标有
的坐标有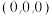 、
、 ,与
,与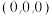 距离最近的
距离最近的 还有
还有②Zn2+占据
③ZnS的密度为
 。
。
您最近一年使用:0次
2021-07-05更新
|
127次组卷
|
2卷引用:江西省赣抚吉名校2022届高三上学期8月联合考试化学试题
解题方法
6 . 很多物质中具有六元环的结构,回答下列问题。
(1)六氯环三磷腈分子中包含一个六元环, 是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50 ℃即可升华。 在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为: 3PCl5+ 3NH4Cl= P3N3Cl6+ 12HCl。

①比较P元素和Cl元素的第一电离能: P_______ _Cl(填“> ”或“<”)。
②在上述反应中断裂的化学键有_______ (填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键 E. 氢键
③P3N3Cl6的晶体类型为_______ 。
(2)1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:

①由A转化为B时,π键数目_______ (填“增加”、 “减少”或“不变”)。
②由B转化为C时,C比B多增加了一种微粒间作用力,该作用力是_______ 。
(3)S和Ge可构成(Ge4S10)4-,Ge和S原子也联结成六边形结构,如图所示。

①基态Ge原子的简化电子排布式为_______ 。
②图中涂黑的微粒代表_______ 元素。
(4)立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,其最小环也是六边形结构。其晶胞结构与金刚石相似,则一个硼原子与相邻氮原子构成的空间构型为_______ 。若氮化硼晶胞边长a pm,则B-N键的键长为_______ pm。

(1)六氯环三磷腈分子中包含一个六元环, 是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50 ℃即可升华。 在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为: 3PCl5+ 3NH4Cl= P3N3Cl6+ 12HCl。

①比较P元素和Cl元素的第一电离能: P
②在上述反应中断裂的化学键有
A.离子键 B.配位键 C.极性键 D.非极性键 E. 氢键
③P3N3Cl6的晶体类型为
(2)1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:

①由A转化为B时,π键数目
②由B转化为C时,C比B多增加了一种微粒间作用力,该作用力是
(3)S和Ge可构成(Ge4S10)4-,Ge和S原子也联结成六边形结构,如图所示。

①基态Ge原子的简化电子排布式为
②图中涂黑的微粒代表
(4)立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,其最小环也是六边形结构。其晶胞结构与金刚石相似,则一个硼原子与相邻氮原子构成的空间构型为

您最近一年使用:0次
名校
解题方法
7 . 目前新合成的砷化镉(Cd3As2)三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为___________ 。Cd原子中第一电离能相对较大的是___________ 原子(填“基态”或“激发态”)。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3___________ PH3(填“>”或“<”),原因是___________ 。
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(4)含砷有机物“对氨基苯砷酸”的结构简式如图,As原子轨道杂化类型为___________ ,1mol对氨基苯砷酸含σ数目为___________ 。

(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___________ 空隙和___________ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___________ 。
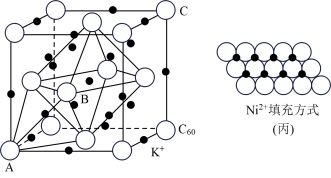
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为anm,每平方米面积上分散的该晶体的质量为___________ g(用a、NA表示)。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯砷酸”的结构简式如图,As原子轨道杂化类型为

(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为anm,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
2021-05-28更新
|
385次组卷
|
2卷引用:河北省石家庄市第二中学2021-2022学年高三上学期九月第四次考试化学试题
8 . I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
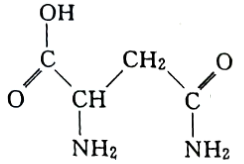
(1)天冬酰胺所含元素中,___________ (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型为___________ 。
(3)写出铬元素基态原子的电子排布式___________ 。
(4)H2S和H2Se的参数对比见下表。
H2S的键角大于H2Se的原因可能为___________ 。
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。
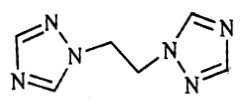
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是___________ 和___________ (填元素符号),配位数为___________ 。
②1molbte分子中含σ键的数目为___________ 。
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3___________ ,CoCl3·4NH3(绿色和紫色)___________ 。

(1)天冬酰胺所含元素中,
(2)天冬酰胺中碳原子的杂化轨道类型为
(3)写出铬元素基态原子的电子排布式
(4)H2S和H2Se的参数对比见下表。
| 化学式 | 键长/nm | 键角 | 沸点/°C |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。

①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是
②1molbte分子中含σ键的数目为
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3
您最近一年使用:0次
名校
解题方法
9 . 过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)铂可溶于王水(浓盐酸和浓硝酸按体积比为3∶1组成的混合物),王水中含有亚硝酰氯(NOCl)。NOCl分子中各原子满足8电子稳定结构。基态氮原子的外围电子排布图为___________ ,NOCl分子中 键和
键和 键的个数比为
键的个数比为___________ 。
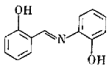
(2)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与 形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有
形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有___________ (填“sp”、“ ”或“
”或“ ”)杂化,锰试剂
”)杂化,锰试剂___________ (填“能”或“不能”)形成分子内氢键。
(3)EAN规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合EAN规则的配合物分
子结构和化学性质都较稳定。已知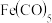 和
和 ,均符合EAN规则,性质稳定,而
,均符合EAN规则,性质稳定,而 在化学反应中表现氧化性。
在化学反应中表现氧化性。
①
___________ 。
②结合上述信息解释 在化学反应中表现氧化性的原因:
在化学反应中表现氧化性的原因:___________ 。
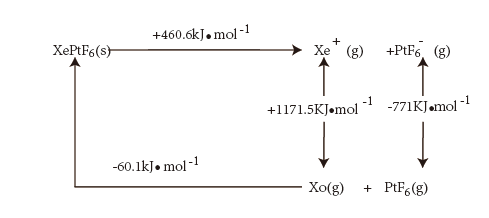
(4)氙的一种配合物六氟合铂酸氙,其化学式为 ,不溶于
,不溶于 等非极性溶剂,且加热熔化可产生
等非极性溶剂,且加热熔化可产生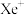 和
和 两种离子。据此可确定
两种离子。据此可确定 中化学键的类型为
中化学键的类型为___________ 。利用如图born-Habe循环计算得到Xe(g)和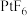 (g)合成
(g)合成 (s)的反应热。Xe原子的第一电离能为
(s)的反应热。Xe原子的第一电离能为___________  ,
, (s)的晶格能为
(s)的晶格能为___________  。
。
(5)在金属铜表面覆盖WBN型氮化硼(熔点为2967 )也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。
)也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。

①WBN型氮化硼晶体中N原子的配位数为___________ 。
②已知阿伏加德罗常数的值为 ,则WBN型氮化硼的密度为
,则WBN型氮化硼的密度为___________ 。
(1)铂可溶于王水(浓盐酸和浓硝酸按体积比为3∶1组成的混合物),王水中含有亚硝酰氯(NOCl)。NOCl分子中各原子满足8电子稳定结构。基态氮原子的外围电子排布图为
 键和
键和 键的个数比为
键的个数比为(2)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与
 形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有
形成黄色的配合物。锰试剂的结构如图所示,锰试剂分子中原子采取的杂化方式有 ”或“
”或“ ”)杂化,锰试剂
”)杂化,锰试剂
(3)EAN规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合EAN规则的配合物分
子结构和化学性质都较稳定。已知
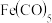 和
和 ,均符合EAN规则,性质稳定,而
,均符合EAN规则,性质稳定,而 在化学反应中表现氧化性。
在化学反应中表现氧化性。①

②结合上述信息解释
 在化学反应中表现氧化性的原因:
在化学反应中表现氧化性的原因:(4)氙的一种配合物六氟合铂酸氙,其化学式为
 ,不溶于
,不溶于 等非极性溶剂,且加热熔化可产生
等非极性溶剂,且加热熔化可产生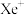 和
和 两种离子。据此可确定
两种离子。据此可确定 中化学键的类型为
中化学键的类型为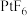 (g)合成
(g)合成 (s)的反应热。Xe原子的第一电离能为
(s)的反应热。Xe原子的第一电离能为 ,
, (s)的晶格能为
(s)的晶格能为 。
。
(5)在金属铜表面覆盖WBN型氮化硼(熔点为2967
 )也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。
)也可以达到金属铜的防腐目的,已知WBN型氮化硼晶体为六方晶系,其结构单元如图所示。
①WBN型氮化硼晶体中N原子的配位数为
②已知阿伏加德罗常数的值为
 ,则WBN型氮化硼的密度为
,则WBN型氮化硼的密度为
您最近一年使用:0次
10 . 铜及其合金是人类最早使用的金属材料。
(1)铜原子的价电子排布式是___________ 。
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为___________ 。

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为___________ 。
且[Cu(NH3)4]2+中存在的化学键类型有___________ (填序号)。
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有___________ σ键和___________ π键。
(1)铜原子的价电子排布式是
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为
且[Cu(NH3)4]2+中存在的化学键类型有
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有
您最近一年使用:0次



